Đề thi học sinh giỏi Hóa 9 năm 2020 - Đề số 2
Đề thi học sinh giỏi Hóa 9 có đáp án
Đề thi học sinh giỏi Hóa 9 năm 2020 - Đề số 2 được đội ngũ giáo viên VnDoc biên soạn, nội dung đề gồm các dạng bài tập nâng cao, khó đòi hỏi các bạn học sịnh phải vận dụng cao, giúp các em làm quen, luyện tập với các dạng câu bài tập trong cấu trúc đề thi học sinh giỏi Hóa học 9.
- Tuyển tập 40 bài tập Hóa học nâng cao lớp 8
- Đề thi học sinh giỏi môn Hóa học 9 năm 2020
- Đề thi chọn học sinh giỏi lớp 9 môn Hóa học Phòng GD&ĐT quận Đống Đa năm học 2019 - 2020
ĐỀ THI HỌC SINH GIỎI HÓA 9
NĂM HỌC 2019 - 2020
Bản quyền thuộc về VnDoc nghiêm cấm mọi hành vi sao chép vì mục đích thương mại
Đề số 2
Câu 1. (3 điểm)
Hoàn thành sơ đồ bằng phương trình phản ứng:
Al → Al2O3 → Al(NO3)3 → Al(OH)3 → Na[Al(OH)4] → Al(OH)3 → Al2O3 → Na[Al(OH)4] → Al2(SO4)3 → KAl(SO4)2.12H2O
Câu 2. (4 điểm)
(1) Bằng phương pháp hóa học, hãy tách riêng từng chất khỏi hỗn hợp CuO, Al2O3, SiO2
(2) Có 5 lọ đựng 5 dung dịch không nhãn gồm: Na2CO3, BaCl2, MgCl2, H2SO4. Không được sử dụng hóa chất nào khác hãy nhận biết các hóa chất trên bằng phương pháp hóa học.
Câu 3. (4 điểm)
Cho hình vẽ sau:
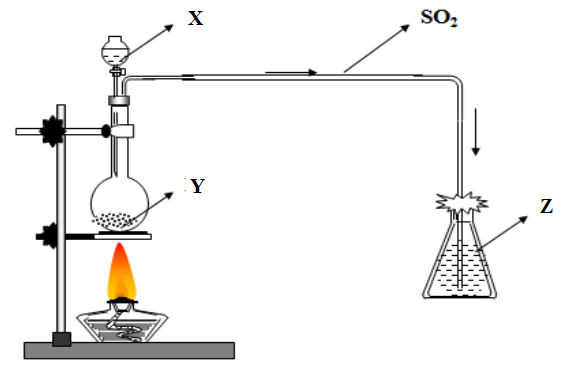
(1) Hình vẽ trên mô tả thí nghiệm điều chế và nghiên cứu tính khử của khí nào trong phòng thí nghiệm?
(2) Xác đinh các chất X, Y, Z trong thí nghiệm trên
(3) Cho biết bông trên thí nghiệm được tẩm NaOH, hãy cho biết tại sao phải dùng bông tẩm NaOH ở miệng bình thu khí?
(4) Nếu dùng các dung dich Ca(OH)2, H2SO4 thay cho NaOH có được không?
(5) Nêu tính chất hóa học của khí được điều chế ở hình vẽ trên?
(6) Viết tất cả phương trình hóa học biểu diễn thí nghiệm trên?
Câu 4. (4 điểm)
Có các chất lỏng A, B, C, D, E. Chất nào là benzen, ancol etylic, axit axetic, dung dịch glucozơ, nước. Biết kết quả của những thí nghiệm như sau:
- Cho tác dụng với Na thì A, B, C, D có khí bay ra; E không phản ứng
- Cho tác dụng với CaCO3 thì A, B, C, E không phản ứng; D có khí bay ra
- Cho tác dụng với dung dịch AgNO3/NH3 thì A, C, D, E bạc không xuất hiện; B có bạc xuất hiện
- Đốt trong không khí thì A, E cháy dễ dàng; D có cháy ; B,C không cháy
Xác định A, B, C, D, E và viết các phương trình phản ứng hoá học theo các kết quả thí nghiệm trên.
Câu 5. (5 điểm)
(1) Hoà tan hoàn toàn 5,68 gam hỗn hợp A gồm MgCO3 và CaCO3 trong dung dịch HCl dư, khí CO2 thu được cho hấp thụ hoàn toàn bởi 225 ml dung dịch Ba(OH)2 0,2M tạo ra 5,91 gam kết tủa. Tính số mol của mỗi chất trong A.
(2) Đốt cháy hoàn toàn một lượng chất hữu cơ X cần 6,72 lít O2 (đktc). Khi cho toàn bộ sản phẩm cháy chỉ có CO2 và H2O vào một lượng nước vôi trong, thu được 10 gam kết tủa và 200ml dung dịch muối có nồng độ 0,5M, dung dịch muối này nặng hơn nước vôi ban đầu là 8,6 gam. Xác định công thức đơn giản nhất của X.
Gợi ý hướng dẫn giải đề thi học sinh giỏi 9
Câu 1.
1) 4Al + 3O2 → 2Al2O3
2) Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O
3) Al(NO3)3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4NO3
4) Al(OH)3 + NaOH → Na[Al(OH)4]
5) K[Al(OH)4] + CO2 → Al(OH)3 + KHCO3
6) 2Al(OH)3 → 2Al2O3 + 3H2O
7) Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
8) 2K[Al(OH)4] + 4H2SO4 → Al2(SO4)3 + K2SO4 + 4H2O
9) Al2(SO4)3 + K2SO4 + 24H2O → 2KAl(SO4)2.12H2O
Câu 2.
(1) Ta nhận thấy hỗn hợp gồm: 1 oxit bazo, 1 oxit lưỡng tính, một oxit axit. Vì vậy nên dùng dung dịch HCl để hòa tan, thu được SiO2:
Tách Al2O3 và CuO theo sơ đồ sau

(2)
Trích ở mỗi lọ 1 ít mẫu thử rồi đánh số thứ tự, rồi lần lượt cho mẫu thử này phản ứng với các mẫu thử còn lại, ta được các kết quả sau:
- Mẫu thử nào tác dụng với các mẫu thử còn lại cho 2 kết tủa là 1 khí là: Na2CO3
- Mẫu thử nào tác dụng với các mẫu thử còn lại cho 2 kết tủa là: BaCl2
- Mẫu thử nào tác dụng với các mẫu thử còn lại cho 1 kết tủa là 1 khí là: H2SO4
- Mẫu thử nào tác dụng với các mẫu thử còn lại cho 1 kết tủa là: MgCl2
Các phương trình hóa học:
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
Na2CO3 + MgCl2 → 2Nacl + MgCO3↓
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
Câu 3.
(1) Hình vẽ trên mô tả thí nghiệm điều chế khí SO2 và thử tính khử của khí SO2 trong phòng thí nghiệm
(2) Các chất X, Y, Z lần lượt có trong thí nghiệm trên là: H2SO4 loãng, Na2SO3, Br2
(3) Khí SO2 đầy thì sẽ thoát ra ngoài , gây độc (vì SO2 là một khí độc), chính vì vậy phải sử dụng bông tẩm NaOH để hấp thụ khí SO2 không cho khí SO2 thoát ra ngoài.
(4) Dung dịch SO2 là một oxit axit nên nó phản ứng với dung dịch kiểm, không phản ứng với axit nên có thẻ thay NaOH bằng một dung dịch kiềm khác như KOH, Ca(OH)2
Nhưng không thể dùng các axit như H2SO4 vì H2SO4 không phản ứng với SO2 nên không giữ được SO2
- Học sinh tự làm câu (5), (6)
Câu 4.
Từ các kết quả xác định được
A: C2H5OH
B là dung dịch glucozơ ( C6H12O6)
C: H2O
D: CH3COOH
E: C6H6(benzen)
2C2H5OH + 2Na → 2C2H5ONa + H2
2H2O + 2Na → 2NaOH + H2
2CH3COOH + 2Na → 2CH3COONa + H2
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
C6H12O6 + Ag2O C6H12O7 + 2Ag
C2H5OH + 3O2 → 2CO2 + 3H2O
CH3COOH + 2O2 → 2CO2 + 2H2O
2C6H6 + 15O2 → 12CO2 + 6H2O
Câu 5:
(1) Gọi số mol của MgCO3 và CaCO3 lần lượt là x, y
Theo đề bài ta có: 84x + 100y = 5,68 (1)
MgCO3 + HCl → MgCl2 + H2O + CO2
CaCO3 + HCl → CaCl2 + H2O + CO2
CO2 + Ba(OH)2 → BaCO3 + H2O
![]()
![]()
So sánh số mol kết tủa và số mol bazo thấy số mol kết tủa nhỏ hơn
Vậy xảy ra 2 TH khi cho CO2 tác dụng với Ba(OH)2
TH1: Ba(OH)2 dư
![]()
Từ đó ta có: x + y = 0,03 mol (2)
Từ (1) và (2) suy ra x = - 0,1675 mol, y = 0,1975 mol (loại)
Trường hợp 2: Xảy ra phản ứng hòa tan một phần kết tủa
CO2 + Ba(OH)2 → BaCO3 + H2O
BaCO3 + H2O + CO2 →Ba(HCO3)2
![]()
Từ đó ta có : x + y = 0,06 (3)
Từ (1) và (3) suy ra: x = 0,02 mol, y = 0,04 mol

(2) Theo đề bài ta có:
![]()
Phương trình hóa học: CO2 + Ca(OH)2 → CaCO3 + H2O
0,1 mol 0,1 mol
CO2 + Ca(OH)2 → Ca(HCO3)2
Tổng số mol CO2 = 0,3 mol
Theo đề bài ta có: mdd tăng = 8,6 gam = (m CO2 + m H2O) hấp thụ - m ↓
=> m H2O = 8,6 + m↓ - m CO2 = 5,4 gam => n H2O = 0,3 mol
Goij CTTQ của M là CxHyOz
Phương trình phản ứng hóa học:
![]()
amol ![]() amol axmol 0,5aymol
amol axmol 0,5aymol
n CO2 = ax = 0,3= n C
n H2O = 0,5ay= 0,3 => ay = 0,6 = nH
nO2 = ![]() a = 0,3 mol => az= 0,3 mol
a = 0,3 mol => az= 0,3 mol
=> x : y : z = 0,3 : 0,6 : 0,3 = 1 : 2 : 1
CTĐGN: CH2O
Đề thi học sinh giỏi Hóa 9 năm 2020 - Đề số 2 được VnDoc biên soạn là đề thi luyện tập dành bồi dưỡng học sinh giỏi Hóa 9, nội dung câu hỏi đưa ra các dạng chuyên đề nâng cao của Hóa học 9 giúp các bạn luyện tập nắm được nội dung cấu trúc đề thi, hi vọng tài liệu này sẽ giúp bạn đạt được kết quá tốt trong kì thi tới.
Trên đây VnDoc đã giới thiệu Đề thi học sinh giỏi Hóa 9 năm 2020 - Đề số 2 tới các bạn. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán 9, Giải SBT Vật Lí 9, Lý thuyết Sinh học 9, Chuyên đề Hóa học 9. Tài liệu học tập lớp 9 mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Luyện thi lớp 9 lên lớp 10 Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.











