Giải bài tập Hóa học 11 SBT bài 32
Giải bài tập Hóa học 11 SBT bài Ankin
- Bài tập trắc nghiệm 6.25 trang 46 sách bài tập (SBT) hóa học 11
- Bài tập trắc nghiệm 6.26, 6.27 trang 46 sách bài tập (SBT) hóa học 11
- Bài tập 6.28 trang 46 sách bài tập (SBT) hóa học 11
- Bài tập 6.29 trang 46 sách bài tập (SBT) hóa học 11
- Bài tập 6.30 trang 47 sách bài tập (SBT) hóa học 11
- Bài tập 6.31 trang 47 sách bài tập (SBT) hóa học 11
VnDoc xin giới thiệu tới các bạn học sinh Giải bài tập Hóa học 11 SBT bài 32. Tài liệu được giải chi tiết sẽ giúp các bạn giải Hóa học lớp 11 hiệu quả hơn. Mời các bạn tham khảo chi tiết bài viết dưới đây nhé.
Giải bài tập Hóa học 11 SBT bài 32 Ankin vừa được VnDoc.com sưu tập và xin gửi tới bạn đọc cùng tham khảo. Bài viết được tổng hợp gồm có lời giải của 7 bài tập trong sách bài tập môn Hóa học lớp 11 bài Ankin. Qua bài viết bạn đọc có thể thấy được cách viết phương trình hoá học của phản ứng, cách xác định công thức phân tử và phần trăm về thể tích của từng chất... Mời các bạn cùng tham khảo chi tiết và tải về tại đây nhé.
Bài tập trắc nghiệm 6.25 trang 46 sách bài tập (SBT) hóa học 11
6.25. Chất  có tên là gì?
có tên là gì?
A. 2,2-đimetylbut-1-in
B. 2,2-đimetylbut-3-in
C. 3,3-đimetylbut-1-in
D. 3,3-đimetylbut-2-in
Hướng dẫn trả lời:
6.25. D
Bài tập trắc nghiệm 6.26, 6.27 trang 46 sách bài tập (SBT) hóa học 11
6.26. Có 4 chất: metan, etilen, but-1-in và but-2-in. Trong 4 chất đó, có mấy chất tác dụng được với dung dịch AgNO3 trong amoniac tạo thành kết tủa?
A. 4 chất
B. 3 chất
C. 2 chất
D. 1 chất
6.27. Mỗi nhận xét sau đây đúng hay sai?
1. Tất cả các ankin đều cháy khi được đốt trong oxi.
2. Tất cả các ankin đều làm mất màu dung dịch KMnO4.
3. Tất cả các ankin đều làm mất màu dung dịch brom.
4. Tất cả các ankin đều tác dụng với dung dịch AgNO3 trong amoniac.
5. Tất cả ankin đều tác dụng được với hiđro ở nhiệt độ cao và có chất xúc tác Ni.
Hướng dẫn trả lời:
6.26. D
6.27.
1. Đúng;
2. Đúng;
3. Đúng;
4. Sai;
5. Đúng.
Bài tập 6.28 trang 46 sách bài tập (SBT) hóa học 11
6.28. Viết phương trình hoá học của phản ứng thực hiện các biến hoá dưới đây và ghi rõ điều kiện phản ứng (nếu có).
![]()
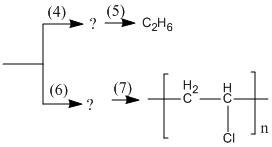
Hướng dẫn trả lời:
(1) ![]()
(2) ![]()
(3) ![]()
(4) ![]()
(5) ![]()
(6) ![]()
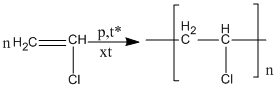
(7) 
Bài tập 6.29 trang 46 sách bài tập (SBT) hóa học 11
6.29. Hỗn hợp khí A chứa hiđro và một ankin. Tỉ khối của A đối với hiđro là 4,8. Đun nóng hỗn hợp A có mặt chất xúc tác Ni thì phản ứng xảy ra với hiệu suất được coi là 100%, tạo ra hỗn hợp khí B không làm mất màu nước brom và có tỉ khối đối với Hiđro là 8.
Hãy xác định công thức phân tử và phần trăm về thể tích của từng chất trong hỗn hợp A và hỗn hợp B.
Hướng dẫn trả lời:
Giả sử trong 1 mol A có X mol CnH2n-2 và (1 - x) mol H2. Khối lượng của 1 mol A là:
MA = (14n - 2)x + 2(1 - x) = 4,8.2 = 9,6 (g/mol) (1)
Khi đun nóng 1 mol A có mặt Ni, tất cả ankin đã biến hết thành ankan (vì B không tác dụng với nước brom):
![]()
x mol 2x mol x mol
Số mol khí còn lại trong B là (1 - 2x) mol nhưng khối lượng hỗn hợp B vẫn bằng khối lượng hỗn hợp A tức là bằng 9,6 g. Khối lượng của 1 mol B:
![]()
Thay x = 0,2 vào (1), tìm được n = 3.
Hỗn hợp A: C3H4 chiếm 20%, H2 chiếm 80%.
Hỗn hợp B: C3H8 chiếm ![]() . 100% = 33%
. 100% = 33%
Vậy H2 chiếm 67%.
Bài tập 6.30 trang 47 sách bài tập (SBT) hóa học 11
6.30. Hỗn hợp khí A chứa C2H2 và H2. Tỉ khối của A đối với hiđro là 5. Dẫn 20,16 lít A đi nhanh qua chất xúc tác Ni nung nóng thì nó biến thành 10,8 lít hỗn hợp khí B. Dẫn hỗn hợp B đi từ từ qua bình đựng nước brom (có dư) cho phản ứng xảy ra hoàn toàn thì còn lại 7,39 lít hỗn hợp khí C. Các thể tích được đo ở đktc.
1. Tính phần trăm thể tích từng chất trong mỗi hỗn hợp A, B và C.
2. Khối lượng bình đựng nước brom tăng thêm bao nhiêu gam?
Hướng dẫn trả lời:
1. Giả sử trong 20,16 lít A có x mol C2H2 và y mol H2.
ta có: ![]()
![]()
Giải hệ phương trình ta có x = 0,3 ; y = 0,6.
Thành phần hỗn hợp A: C2H2 chiếm ![]() . 100% = 33,33%
. 100% = 33,33%
H2 chiếm 100% - 33,33% = 66,67%
Khi A qua chất xúc tác Ni, xảy ra phản ứng cộng. C2H2 hợp hiđro có thể tạo thành C2H4 hoặc thành C2H6 hoặc thành cả 2 chất đó:
![]()
Số mol khí trong hỗn hợp B: ![]()
Trong hỗn hợp A có 0,3 mol C2H2 thì trong hỗn hợp B cũng có 0,3 mol các hiđrocacbon.
Số mol H2 trong B là: 0,45 - 0,3 = 0,15 (mol).
Số mol H2 đã tham gia phản ứng: 0,6 - 0,15 = 0,45 (mol).
Khi B đi qua nước brom dư, những hiđrocacbon không no đều bị giữ lại hết (phản ứng hoàn toàn).
Vậy hỗn hợp C chỉ còn lại C2H6 và H2 với số mol tổng cộng là: ![]() ; trong đó số mol H2 là 0,15 mol, vậy số mol C2H6 là: 0,33 - 0,15 = 0,18 (mol).
; trong đó số mol H2 là 0,15 mol, vậy số mol C2H6 là: 0,33 - 0,15 = 0,18 (mol).
Thành phần hỗn hợp C: C2H6 chiếm ![]() . 100% = 54,55% ; 0,330
. 100% = 54,55% ; 0,330
H2 chiếm 100% - 55,45% = 45,45%.
Trong hỗn hợp B cũng phải có 0,18 mol C2H6. Để tạo ra 0,18 mol C2H6 cần 0,36 mol H2 tác dụng với C2H2. Vậy lượng H2 tác dụng với C2H2 để tạo ra C2H4 là: 0,45 - 0,36 = 9.10-2 (mol).
Lượng C2H4 trong hỗn hợp B là 9.10-2 (mol) và lượng C2H2 trong B là:
0,3 - 0,18 - 9.10-2 = 3.10-2 mol.
Thành phần hỗn hợp B:
C2H6 chiếm ![]() . 100% = 40% ;
. 100% = 40% ;
C2H4 chiếm ![]() . 100% = 20% ;
. 100% = 20% ;
C2H2 chiếm ![]() . 100% = 6,67% ;
. 100% = 6,67% ;
H2 chiếm ![]() . 100% = 33,33%.
. 100% = 33,33%.
2. Khối lượng bình đựng nước brom tăng thêm:
![]()
Bài tập 6.31 trang 47 sách bài tập (SBT) hóa học 11
6.31. Hỗn hợp khí A chứa hiđro, một anken và một ankin. Đốt cháy hoàn toàn 90 ml A thu được 120 ml CO2. Đun nóng 90 ml A có mặt chất xúc tác Ni thì sau phản ứng chỉ còn lại 40 ml một ankan duy nhất. Các thể tích đo ở cùng một điều kiện.
1. Xác định công thức phân tử và phần trăm thể tích từng chất trong hỗn hợp A.
2. Tính thể tích O2 vừa đủ để đốt cháy hoàn toàn 90 ml A.
Hướng dẫn trả lời:
1. Anken và ankin có thể biến thành cùng một ankan, vậy 2 chất đó có cùng số nguyên tử cacbon. Giả sử 90 ml A có x mol CnH2n, y ml CnH2n-2, z ml H2.
x + y + z = 90 (1)
![]()
x ml nx ml
![]()
y ml ny ml
![]()
Thể tích CO2: n(x + y) = 120 (2)
![]()
x ml x ml x ml
![]()
y ml 2y ml y ml
H2 đã phản ứng: x + 2y = z (3)
Thể tích ankan: x + y = 40 (4)
Giải hệ phương trình tìm được x = 30, y = 10, z = 50, n = 3
Hỗn hợp A: C3H6 (33%); C3H4 (11%); H2 (56%).
2) Thể tích O2 là 200 ml.
Để có kết quả học tập lớp 11 tốt hơn. VnDoc Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- Giải bài tập Hóa học 11 SBT bài 31
- Trắc nghiệm Hóa học lớp 11 bài 32: Ankin
- Trắc nghiệm Hóa học lớp 11 bài 33: Luyện tập ankin
- Giải bài tập trang 145 SGK Hóa học lớp 11: Ankin
----------------------------------
Trên đây VnDoc đã giới thiệu tới bạn đọc Giải bài tập Hóa học 11 SBT bài 32 Ankin. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Sinh học 11, Giải bài tập Vật lý 11, Giải bài tập Hóa học 11, Giải bài tập Toán 11 mà VnDoc tổng hợp và đăng tải.
Mời bạn đọc cùng tham gia nhóm Tài liệu học tập lớp 11 để có thêm tài liệu học tập nhé



















