Hạt nhân nguyên tử nguyên tố hóa học đồng vị
Hóa 10 bài 2: Hạt nhân nguyên tử nguyên tố hóa học đồng vị
Hạt nhân nguyên tử nguyên tố hóa học đồng vị được VnDoc biên soạn gửi tới bạn đọc là nội dung lý thuyết và các dạng bài tập hạt nhân nguyên tử cũng như các dạng bài tập đồng vị. Mời các bạn tham khảo.
A. Lý thuyết trọng tâm
I. HẠT NHÂN NGUYÊN TỬ
1. Điện tích hạt nhân
Proton mang điện tích 1+
=> có Z proton thì điện tích của hạt nhân bằng Z+ và số đơn vị điện tích hạt nhân bằng Z.
Nguyên tử trung hoà về điện nên số proton trong hạt nhân bằng số electron của nguyên
Số đơn vị điện tích hạt nhân Z = số proton = số electron
2. Số khối
Số khối (kí hiệu là A) là tổng số hạt proton (kí hiệu là Z) và tổng số hạt nơtron (kí hiệu là N) của hạt nhân đó :
A = Z + N
II. NGUYÊN TỐ HOÁ HỌC
1. Định nghĩa
Nguyên tố hoá học là những nguyên tử có cùng điện tích hạt nhân.
2. Số hiệu nguyên tử
Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử của nguyên tố đó, kí hiệu là Z.
3. Kí hiệu nguyên tử
Số đơn vị điện tích hạt nhân và số khối được coi là những đặc trưng cơ bản của nguyên tử.
Kí hiệu nguyên tử: ![]()
X: Nguyên tố hóa học
A: Số khối của nguyên tố X
Z: Số đơn vị điện tích hạt nhân của nguyên tố X
III. ĐỒNG VỊ
- Các nguyên tử của cùng một nguyên tố hoá học có thể có số khối khác nhau vì hạt nhân của các nguyên tử đó có số proton như nhau nhưng có thể có số nơtron khác nhau.
- Các đồng vị của cùng một nguyên tố hoá học là những nguyên tử có cùng số proton nhưng khác nhau vể số nơtron.
=> A của các đồng vị sẽ khác nhau.
- Các đồng vị được xếp vào cùng 1 ô nguyên tố trong bảng tuần hoàn hóa học.
Ngoài khoảng 340 đồng vị tự nhiên, người ta còn tổng hợp thêm 2400 đồng vị nhân tạo dùng trong y học, nông nghiệp.
IV. NGUYÊN TỬ KHỐI VÀ NGUYÊN TỬ KHỐI TRUNG BÌNH CỦA CÁC NGUYÊN TỐ HOÁ HỌC
1. Nguyên tử khối
Nguyên tử khối là khối lượng tương đối của nguyên tử và cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
- Khối lượng của một nguyên tử bằng tổng khối lượng của proton, nơtron và electron trong nguyên tử đó, nhưng do khối lượng của electron quá nhỏ bé so với hạt nhân nên khối lượng một nguyên tử coi như bằng hạt nhân nguyên tử
=> Nguyên tử khối coi như bằng số khối (A)
2. Nguyên tử khối trung bình
Nguyên tử khối trung bình = 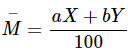
với a, b là % số nguyên tử của hai đồng vị X, Y.
B. Bài tập vận dụng
Bài 1. Một oxit có công thức X2O có tổng số hạt là 66. Số hạt không mang điện ít hơn số hạt mang điện là 22. Xác định công thức oxit
Bài 2. Hợp chất MX2. Trong phân tử MX2, tổng số hạt cơ bản là 140 và số hạt mang điện nhiều hơn số hạt không mang điện là 44. Số khối của X lớn hơn số khối của M là 11. Tổng số hạt cơ bản trong X nhiều hơn trong M là 16 hạt. Xác định kí hiệu M, X và công thức MX2 ( khối A)
Bài 3. Tính khối lượng trung bình của các nguyên tố trong các trường hợp sau đây:
a/ Clo trong tự nhiên có 2 đồng vị bền ![]() chiếm 75,77% và
chiếm 75,77% và ![]()
b/ Niken có 3 đồng vị 58Ni ( 67%); 60Ni(26%); 61Ni.
c/ Nguyên tố Bo có 2 đồng vị 11B (80,1%), 10B (19,9%)
d/ Oxi có 3 đồng vị: 16O (99,757%); 17O (0,039%); 18O (0,204%)
Bài 4. Tính % số nguyên tử của các đồng vị của các nguyên tố:
a/ Cacbon có 2 đồng vị ![]() ,
, ![]() có khối lượng nguyên tử trung bình là: 12,011
có khối lượng nguyên tử trung bình là: 12,011
b/ Đồng có 2 đồng vị là: ![]() ,
, ![]() có khối lượng nguyên tử trung bình là: 63,54
có khối lượng nguyên tử trung bình là: 63,54
Bài 5. Tìm số khối của đồng vị còn lại
a/ Nguyên tử trung bình của bạc là 107,88. Bạc có hai đồng vị, trong đó 109Ag chiếm 44%
b/ Cho nguyên tử khối trung bình của magie là 24,372. Số khối các đồng vị lần lượt là 24; 25; và A3. Phần trăm số nguyên tử tương ứng của A1, A2 lần lượt là 78,6% và 10,9%. Tìm A3
Bài 6. Khối lượng nguyên tử Clo là 35,5. Clo có 2 đồng vị là ![]() và
và ![]() .
.
a/ Tính % số nguyên tử mỗi đồng vị
b/ Tính % khối lượng của đồng vị ![]() trong HClO4; % khối lượng của đồng vị trong HClO4
trong HClO4; % khối lượng của đồng vị trong HClO4
Bài 7. Trong tự nhiên oxi có 3 đồng vị: 16O, 17O,18O.
Cacbon có 2 đồng vị: 12C; 13C. Hỏi có thể tạo được bao nhiêu phân tử CO2?
C. Tài liệu liên quan
- Hóa 10 Bài 2: Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị
- Giải bài tập Hóa 10 Bài 2: Hạt nhân nguyên tử, nguyên tố hoá học, đồng vị
- Trắc nghiệm Hóa học 10 bài 2: Hạt nhân nguyên tử. Nguyên tố hóa học. Đồng vị
.................
Trên đây VnDoc đã giới thiệu Hạt nhân nguyên tử nguyên tố hóa học đồng vị tới các bạn. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.











