Đề thi học sinh giỏi tỉnh Cà Mau lớp 12 năm 2012 môn Hóa học
Để chuẩn bị cho kỳ thi chọn học sinh giỏi, Vndoc.com xin giới thiệu đến các bạn: Đề thi học sinh giỏi tỉnh Cà Mau lớp 12 năm 2012 môn Hóa học.
Đề thi học sinh giỏi môn Hóa học:
SỞ GIÁO DỤC VÀ ĐÀO TẠO | ĐỀ THI HỌC SINH GIỎI VÒNG TỈNH LỚP 12 THPT |
Câu I (3 điểm)
Có các dung dịch: MgCl2, BaCl2, ZnCl2, AlCl3, FeCl3. Viết phương trình ion rút gọn các phản ứng xảy ra khi lần lượt thêm vào mỗi dung dịch:
a) Dung dịch NaHCO3 đã đun nóng và để nguội.
b) Dung dịch Na2S.
c) Dung dịch NH3.
Câu II (3 điểm)
1. Trong phòng thí nghiệm có các dung dịch bị mất nhãn: AlCl3, NaCl, KOH, Mg(NO3)2, Pb(NO3)2, Zn(NO3)2, AgNO3. Dùng thêm một thuốc thử là phenolphtalein, hãy nhận biết mỗi dung dịch. Viết phương trình phản ứng (nếu có).
2. Trộn 200 ml dung dịch HCl 0,1M và H2SO4 0,05M với 300 ml dung dịch Ba(OH)2 có nồng độ a mol/lít thu được m gam kết tủa và 500 ml dung dịch có pH = 13. Tính a và m ?
Câu III (3 điểm)
1. Một bình chứa 0,720 mol SO2 và 0,710 mol SO3. Thêm 0,490 mol NO2 và phản ứng đạt đến cân bằng
![]() có 0,390 mol NO khi đạt cân bằng
có 0,390 mol NO khi đạt cân bằng
a) Tính hằng số cân bằng ở nhiệt độ thí nghiệm trên.
b) Ở cùng nhiệt độ trên thêm 1,000 mol SO3 vào bình. Tính số mol 4 chất khí khi đạt cân bằng.
2. Cho khí Clo đi từ từ đến dư qua dung dịch KI thấy màu vàng nâu xuất hiện, sau đó dung dịch đục dần và cuối cùng trở nên trong suốt không màu. Viết phương trình hóa học biểu diễn các phản ứng xảy ra để giải thích hiện tượng thí nghiệm trên.
Câu IV (2 điểm)
Cho sơ đồ biến hóa sau: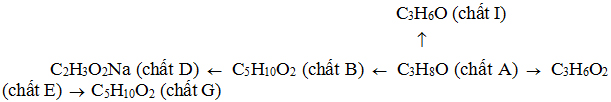
Xác định công thức cấu tạo của các chất A, B, D, E, G, I và viết phương trình hóa học biểu diễn sự biến hóa trên.
Câu V (2 điểm)
1. Dung dịch NH4Cl và dung dịch C6H5NH3Cl đều có nồng độ 0,1 mol/lít. Dung dịch nào có pH lớn hơn? Giải thích.
2. Mentol có trong tinh dầu bạc hà, có công thức cấu tạo như sau:
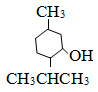
Viết phương trình hóa học biểu diễn phản ứng của Mentol với Na, với Brom (có ánh sáng), CH3COOH (có H2SO4 đặc), CuO đun nóng.
Câu VI (4 điểm)
1. Hỗn hợp gồm fomanđehit, axit axetic và axit fomic có khối lượng 2,33 gam có thể bị trung hòa hoàn toàn bởi 18,7 ml dung dịch KOH 8,4% (khối lượng riêng là 1,07 g/ml). Dung dịch nhận được đem phản ứng với lượng dư dung dịch AgNO3 trong amoniac, đun nóng thấy tách ra 9,72 gam kết tủa. Viết phương trình hóa học biểu diễn các phản ứng và tính số mol từng chất trong hỗn hợp ban đầu.
2. Hợp chất hữu cơ A có chứa Cacbon, Hidro, Oxi. Phân tích định lượng cho kết quả: 46,15% C; 4,62% H; 49,23% O. Biết phân tử khối của A nhỏ hơn 200 đv.C
Tìm công thức phân tử của A. Viết các công thức cấu tạo (có thể có) của A, biết khi đun A với dung dịch NaOH dư thu được 1 muối B và 1 rượu D đều thuần chức (không tạp chức).
Câu VII (3 điểm)
Hòa tan 24 gam Fe2O3 bằng dung dịch HCl dư, sau phản ứng được dung dịch B. Cho vào dung dịch B một lượng m gam hỗn hợp 2 kim loại Mg và Fe thấy thoát ra 2,24 lít khí H2 (đktc), sau phản ứng thu được dung dịch C và chất rắn D có khối lượng bằng 10% so với khối lượng m. Cho dung dịch NaOH dư vào dung dịch C, lọc lấy kết tủa tạo thành đem đun nóng ngoài không khí đến khi khối lượng không đổi được 40 gam chất rắn. Viết các phương trình phản ứng xảy ra và tìm khối lượng mỗi kim loại trong m gam hỗn hợp.
Cho Fe = 56; O = 16; Mg = 24; Ag = 108; H =1; C = 12.