Giải Hóa 9 Bài 8: Một số Bazơ quan trọng (tiếp theo)
VnDoc xin giới thiệu tới các bạn bài Giải Hóa 9 bài 8: Một số Bazơ quan trọng (tiếp theo) bao gồm hướng dẫn giải chi tiết cho các bài tập trong SGK Hóa 9 bài 8, giúp các em nắm vững kiến thức được học về một số bazơ quan trọng trong chương trình Hóa học 9. Mời các bạn tham khảo chi tiết lời giải bài tập Hóa 9 dưới đây.
Giải bài tập hóa 9 trang 30: Một số Bazơ quan trọng (tiếp theo)
A. Tóm tắt kiến thức canxi hiđroxit - Ca(OH)2
1. Tính chất dung dịch canxi hiđroxit
Có tên gọi thông thường là nước vôi trong.
Để có được nước vôi trong tiến hành hòa tan 1 ít vôi tôi Ca(OH)2 trong nước, ta được nước vôi (hay còn gọi vôi sữa), lọc vôi nước thu được chất lỏng trong suốt, không màu là dung dịch Ca(OH)2. còn được gọi là nước vôi trong.
2. Tính chất hóa học
Dung dịch Canxi hiđroxit: Ca(OH)2 có những tính chất của một bazơ tan.
a) Làm đổi màu qùy tím thành xanh, dung dịch phenolphatalein không màu thành màu đỏ.
b) Tác dụng với axit, tạo thành muối và nước (phản ứng trung hòa)
Thí dụ: Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + H2SO4 → CaSO4 + H2O
c) Tác dụng với axit tạo thành muối và nước (phản ứng trung hòa)
Thí dụ: Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + SO2 → Ca2SO3 + H2O
d) Tác dụng với dung dịch muối: tạo ra uối mới + bazơ mới
Thí dụ: Ca(OH)2 + Na2CO3 → CaCO3↓ + 2NaOH
3. Ứng dụng Ca(OH)2
Canxi hiđroxit được dùng:
Làm vật liệu trong xây dựng.
Khử chua đất trồng trọt.
Khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật...
4. Điều chế Ca(OH)2
Để điều chế Ca(OH)2 trong phòng thí nghiệm, chúng ta thường sử dụng vôi sống (CaO) kết hợp với nước.
Công thức phản ứng:
CaO + H2O → Ca(OH)2
Phương pháp nhiệt
Sau khi nung đá vôi thành canxi oxit, nó được xử lý bằng nước theo tỷ lệ 1: 3 để tạo ra dung dịch canxi hydroxit. Sau khi tinh chế và tách, cặn được loại bỏ bằng cách khử nước ly tâm và sấy khô và sau đó sàng lọc thu được canxi hydroxit thành phẩm.
CaCO3 → CaO + CO2 ↑
CaO + H2O → Ca(OH)2
5. Thang PH biểu thị độ axit hoặc bazơ của dung dịch
- PH = 7: Dung dịch trung tính (nước cất có PH = 7)
- PH < 7: Dung dịch có tính axit, PH càng nhỏ độ axit càng lớn.
- PH > 7: Dung dịch có tính bazơ, PH càng lớn độ axit càng lớn
B. Giải bài tập Hóa 9 SGK trang 30: Một số bazơ quan trọng – canxi hiđroxit Ca(OH)2
Bài 1 Trang 30 SGK hóa 9
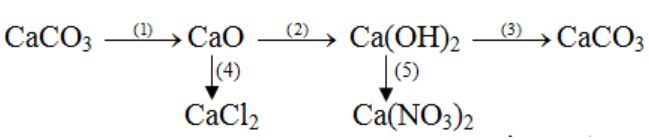
Viết các phương trình hóa học thực hiện những chuyển đổi hóa hoặc sau:
Đáp án hướng dẫn giải chi tiết
(1) CaCO3 → CaO + CO2
(2) CaO + H2O → Ca(OH)2
(3) Ca(OH)2 + CO2 → CaCO3 + H2O
(4) CaO + 2HCl → CaCl2 + H2O
(5) Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
Bài 2 Trang 30 SGK hóa 9
Có ba lọ không nhãn, mỗi lọ đựng một trong ba chất rắn màu trắng sau: CaCO3, CaO, Ca(OH)2. Hãy nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương pháp hóa học.
Đáp án hướng dẫn giải chi tiết
Dùng H2O, quỳ tím để nhận biết được mỗi chất theo sơ đồ nhận biết sau đây:
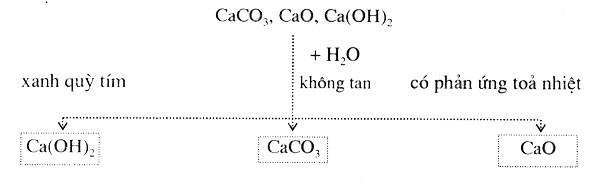
Trích mẫu thử và đánh số thứ tự:
Hòa tan 3 chất rắn vào nước
Chất rắn không tan trong nước là CaCO3, chất rắn tan trong nước và tỏa nhiệt là CaO
CaO + H2O → Ca(OH)2
Chất rắn làm quỳ tím chuyển màu thành xanh là Ca(OH)2
Bài 3 Trang 30 SGK hóa 9
Hãy viết các phương trình hóa học của phản ứng khi cho dung dịch NaOH tác dụng với dung dịch H2SO4 tạo ra:
a) Muối natri hiđrosunfat.
b) Muối natrisunfat.
Đáp án hướng dẫn giải chi tiết
a) H2SO4 + NaOH → H2O + NaHSO4
b) H2SO4 + 2NaOH → 2H2O + Na2SO4
Bài 4 Trang 30 SGK hóa 9
Một dung dịch bão hòa khí CO2 trong nước có pH = 4. Hãy giải thích và viết phương trình hóa học của CO2 với nước.
Đáp án hướng dẫn giải chi tiết
Dung dịch bão hòa CO2 có pH = 4, nghĩa là dung dịch có tính axit yếu. Vì khí CO2 tác dụng với nước tạo thành axit cacbonic, là một axit rất yếu:
CO2 + H2O → H2CO3
>> Bài tiếp theo: Giải Hóa 9 Bài 9: Tính chất hóa học của muối
C. Giải SBT Hóa 9 bài 8
Để giúp các bạn học sinh học tốt hơn, cũng như có thể hoàn thành tốt các dạng bài tập Sách bài tập Hóa 9 bài 8. VnDoc đã biên soạn hướng dẫn giải một cách chi tiết dễ hiểu tại: Giải Sách bài tập Hóa học 9 bài 8
D. Trắc nghiệm Hóa 9 bài 8
Câu 1: Thuốc thử để nhận biết dung dịch Ca(OH)2 là:
A. Na2CO3
B. KCl
C. NaOH
D. NaNO3
Câu 2: Nhóm các dung dịch có pH > 7 là:
A. HCl, NaOH
B. H2SO4, HNO3
C. NaOH, Ca(OH)2
D. BaCl2, NaNO3
Câu 3: Để phân biệt hai dung dịch NaOH và Ba(OH)2 đựng trong hai lọ mất nhãn ta dùng thuốc thử:
A. Quỳ tím
B. HCl
C. NaCl
D. H2SO4
Câu 4: NaOH có tính chất vật lý nào sau đây?
A. Natri hiđroxit là chất rắn không màu, ít tan trong nước
B. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt
C. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh và không tỏa nhiệt
D. Natri hiđroxit là chất rắn không màu, không tan trong nước, không tỏa nhiệt.
Câu 5: Dãy các bazơ bị phân hủy ở nhiệt độ cao:
A. Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3
B. Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2
C. Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2
D. Zn(OH)2, Ca(OH)2, KOH, NaOH
Câu 6: Cặp chất đều làm đục nước vôi trong Ca(OH)2:
A. CO2, Na2O
B. CO2, SO2
C. SO2, K2O
D. SO2, BaO
Câu 7: Cặp oxit phản ứng với nước ở nhiệt độ thường tạo thành dung dịch bazơ là:
A. K2O, Fe2O3
B. Al2O3, CuO
C. Na2O, K2O
D. ZnO, MgO
Câu 8: Cho 2,24 lít khí CO2 (đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch Ca(OH)2, chỉ thu được muối CaCO3. Nồng độ mol của dung dịch Ca(OH)2 cần dùng là:
A. 0,5M
B. 0,25M
C. 0,1M
D. 0,05M
Câu 9: Hòa tan 30 g NaOH vào 170 g nước thì thu được dung dịch NaOH có nồng độ là:
A. 18%
B. 16%
C. 15%
D. 17%
Câu 10: Dẫn 22,4 lít khí CO2 (đktc) vào 200g dung dịch NaOH 20%. Sau phản ứng tạo ra sản phẩm nào trong số các sản phẩm sau:
A. Muối natricacbonat và nước.
B. Muối natri hidrocacbonat
C. Muối natricacbonat.
D. Muối natrihiđrocacbonat và natricacbonat
Mời các bạn theo dõi và tiếp đáp án bài tập trắc nghiệm Hóa 9 bài 8 tại: Trắc nghiệm Hóa học 9 bài 8
.........................................
Ngoài Giải Hóa 9 Bài 8: Một số Bazơ quan trọng (tiếp theo), mời các bạn tham khảo thêm Trắc nghiệm Hóa học 9, Lý thuyết Hóa học 9 và Tài liệu học tập lớp 9 mà VnDoc tổng hợp và đăng tải.








