Đề thi học sinh giỏi lớp 12 THPT tỉnh Kiên Giang năm 2013
Vndoc.com xin gửi đến các bạn: Đề thi học sinh giỏi lớp 12 THPT tỉnh Kiên Giang năm 2013.
Đề thi học sinh giỏi môn Hóa:
SỞ GIÁO DỤC VÀ ĐÀO TẠO
|
KỲ THI CHỌN HỌC SINH GIỎI VÒNG TỈNH LỚP 12 THPT
|
MÔN THI: HÓA (Thời gian: 180 phút)
Câu I (4 điểm):
1. Phi kim R có electron viết sau cùng ứng với 4 số lượng tử có tổng đại số bằng 2,5.
a. Tìm phi kim R. Viết cấu hình electron có thể có của R.
b. Xác định vị trí của R trong bảng tuần hoàn.
c. Sắp xếp theo thứ tự tính phi kim tăng dần.
2. Nguyên tử của nguyên tố A có cấu hình electron thu gọn là: [Khí hiếm] (n – 1)dαns1. Xác định cấu hình electron thu gọn có thể có của A. Từ đó, cho biết vị trí của A trong bảng tuần hoàn? Mỗi trường hợp nêu kí hiệu hóa học của 2 nguyên tố?
Câu II (3 điểm):
1. Viết công thức cấu tạo, nêu dạng hình học, trạng thái lai hóa của nguyên tử trung tâm trong các phân tử và ion sau: BeH2, BCl3H2O, NO3-.
2. Trong các phân tử sau, hãy sắp xếp theo chiều tăng dần góc liên kết: CO2, H2S, SO2, SO3, CH4.
3. So sánh nhiệt độ nóng chảy và độ tan trong nước của các chất sau: KCl, KBr, KI. Giải thích?
Câu III (2 điểm):
Cho cân bằng sau với các dữ kiện nhiệt động của các chất ở 250C: ![]()
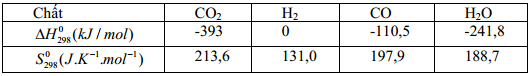
1. Hãy tính ΔHo298, ΔSo298, ΔGo298 của phản ứng và nhận xét phản ứng có tự xảy ra theo chiều thuận ở 250C hay không?
2. Giả sử ΔHo của phản ứng không thay đổi theo nhiệt độ. Hãy tính ΔGo1273 của phản ứng thuận ở 10000C và nhận xét?
Câu IV (5 điểm):
1. Viết các phương trình phản ứng sau và cho biết ứng dụng của mỗi phản ứng:
a. PdCl2 + H2O + CO →
b. Si + KOH + H2O →
c. N2H4 + O2 →
d. Zn3P2 + H2O →
2. Cho m gam hỗn hợp bột Al, Fe, Cu vào 200 gam dung dịch HNO3 63% (d = 1,38 g/ml). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch A và 7,168 lít khí NO2 (ở27,30C và 1,1 atm). Chia A làm 2 phần bằng nhau.
* Phần một cho tác dụng với lượng dư dung dịch NH3, thu được 3,41 gam kết tủa.
* Phần hai cho tác dụng với lượng dưdung dịch NaOH, sau khi phản ứng kết thúc lấy kết tủa đem nung tới khối lượng không đổi, được 2,4 gam chất rắn.
a. Hãy chứng minh kim loại đã tan hết? Xác định giá trị của m? Tính nồng độ% của các chất trong dung dịch A.
b. Cho toàn bộ khí NO2 thu được ở trên vào 500 ml dung dịch NaOH 5M được dung dịch B. Tính nồng độ mol/lít các chất trong dung dịch B.
Câu V (4 điểm):
1. Tính pH để bắt đầu kết tủa Mg(OH)2 từ dung dịch Mg2+ 0,01M và pH để kết tủa hoàn toàn nó. Biết rằng Mg(OH)2 được coi là kết tủa hoàn toàn khi nồng độ ion Mg2+ sau khi kết tủa chỉ còn là 10-6 M và Mg(OH)2 có tích số tan T = 6.10-10.
2. Độ tan của H2S trong dung dịch HClO4 0,003M là 0,1mol/l. Nếu thêm vào dung dịch này các ion Mn2+ và Cu2+ sao cho nồng độ của chúng bằng 2.10-4 M thì ion nào sẽ kết tủa dạng sunfua?
Biết TMnS = 3.10-14, TCuS = 8.10-37, KH2S = 1,3.10-21.
Câu VI (2 điểm):
Chỉ được phép dùng dung dịch NaOH 0,1 M và chất chỉ thị phenolphtalein, hãy phân biệt 3 dung dịch mất nhãn đựng trong 3 lọ riêng biệt gồm: dung dịch A: H2SO4 0,1M; dung dịch B: NaHSO4 0,1M; dung dịch C: H2SO4 0,1M và HCl 0,1M.



