Giải Hóa 10 bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm Cánh diều
Giải Hóa 10 Cánh diều bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Giải Hóa 10 bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm Cánh diều được biên soạn hướng dẫn bạn đọc trả lời các câu hỏi thảo luận, luyện tập và giải các bài tập SGK Hóa 10 Cánh diều bài 7. Mời các bạn tham khảo chi tiết nội dung dưới đây.
>> Bài trước đó: Giải Hóa 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học Cánh diều
A. Trả lời câu hỏi và thảo luận
Câu 1 trang 39 Hóa 10 Cánh diều
Các nguyên tố chu kì 2 có bao nhiêu lớp electron? Vẽ mô hình nguyên tử theo Rutherford – Bohr của Li và F để giải thích về sự khác biệt bán kính nguyên tử.
Hướng dẫn trả lời câu hỏi
Các nguyên tố chu kì 2 có 2 lớp electron.
Mô hình nguyên tử của Li (Z = 3) và F (Z = 9) theo Rutherford – Bohr như sau:
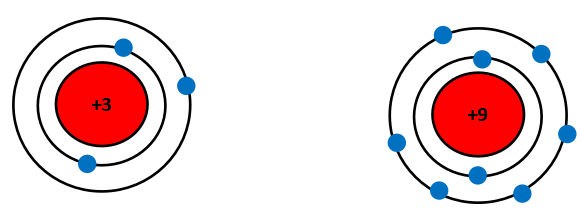
Li và F đều cùng có 2 lớp electron, tuy nhiên điện tích hạt nhân của F lớn hơn Li nên hạt nhân của F sẽ hút electron lớp ngoài cùng mạnh hơn làm cho bán kính nguyên tử F nhỏ hơn Li.
Câu 2 trang 40 Hóa 10 Cánh diều
Dựa vào hình 7.5, hãy nhận xét quy luật chung về sự biến đổi độ âm điện của các nguyên tử nguyên tố nhóm A trong một chu kì, trong một nhóm
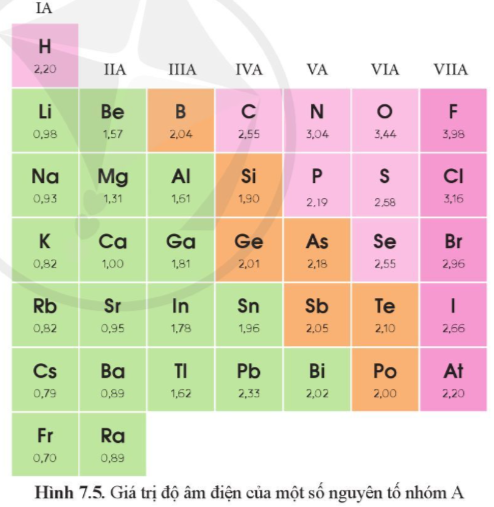
Hướng dẫn trả lời câu hỏi
Các nguyên tố chu kì 3, 4,5 theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần từ trái quá phải.
Câu 3 trang 40 Hóa 10 Cánh diều
Cặp electron liên kết của phân tử H2 có bị lệch về nguyên tử nào không? Vì sao?
Hướng dẫn trả lời câu hỏi
Phân tử H2 được tạo bởi 2 nguyên tử H, đều có độ âm điện là 2,2.
Như vậy lực hút electron của 2 nguyên tử H bằng nhau. Vậy trong phân tử H2 cặp electron sẽ không bị lệch về nguyên tử nào.
Câu 4 trang 41 Hóa 10 Cánh diều
Cặp electron liên kết bị lệch nhiều hơn trong phân tử NH3 hay trong phân tử H2O? Vì sao?
Hướng dẫn trả lời câu hỏi
Độ âm điện của H và N lần lượt là 2,2 và 3,0. Vậy nguyên tử N hút electron liên kết mạnh hơn nguyên tử H, gấp 3,0 : 2,2 = 1,36 lần.
Độ âm điện của H và O lần lượt là 2,2 và 3,4. Vậy nguyên tử N hút electron liên kết mạnh hơn nguyên tử H, gấp 3,4 : 2,2 = 1,54 lần.
Ta thấy 1,54 > 1,36 nên cặp electron liên kết bị lệch nhiều hơn trong phân tử H2O.
Câu 5 trang 42 Hóa 10 Cánh diều
Viết công thức oxide cao nhất của các nguyên tố chu kì 2, từ Li đến N.
Hướng dẫn trả lời câu hỏi
Li thuộc nhóm IA ⟹ Li có hóa trị cao nhất là I, oxide cao nhất là Li2O
Be thuộc nhóm VIIA ⟹ Be có hóa trị cao nhất là II, oxide cao nhất là BeO
B thuộc nhóm IIIA ⟹ B có hóa trị cao nhất là III, oxide cao nhất là B2O3
C thuộc nhóm IVA ⟹ C có hóa trị cao nhất là IV, oxide cao nhất là CO2
N thuộc nhóm VA ⟹ N có hóa trị cao nhất là V, oxide cao nhất là N2O5
Câu 6 trang 44 Hóa 10 Cánh diều
Al(OH)3 thể hiện tính acid, tính base trong phản ứng nào trong ví dụ trên?
Hướng dẫn trả lời câu hỏi
Al(OH)3 thể hiện tính acid khi tác dụng với dung dịch NaOH:
Al(OH)3 + NaOH → Na[Al(OH)4]
Al(OH)3 thể hiện tính base khi tác dụng với dung dịch HCl
Al(OH)3 + 3HCl → AlCl3 + 3H2O
B. Trả lời câu hỏi luyện tập
Câu 1 Luyện tập Trang 39 Hóa 10 Cánh diều
Quan sát hình 7.2, cho biết quy luật biến đổi bán kính nguyên tử của các nguyên tố ở chu kì 3, 4, 5 theo chiều tăng dần điện tích hạt nhân.
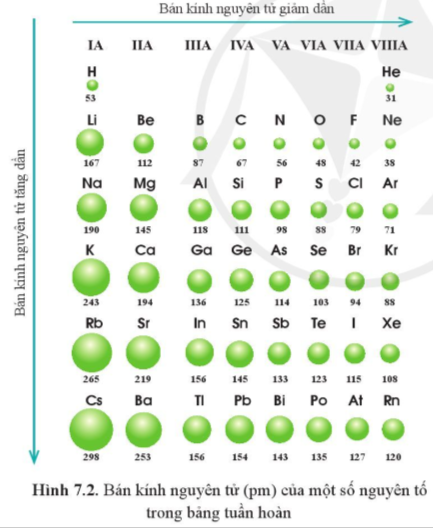
Hướng dẫn trả lời câu hỏi
Các nguyên tố chu kì 3, 4,5 theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần từ trái quá phải.
Câu 2 Luyện tập Trang 39 Hóa 10 Cánh diều
Hãy giải thích vì sao nguyên tử He là nguyên tử nguyên tố có kích thước nhỏ nhất trong bảng tuần hoàn mà không phải nguyên tử H
Hướng dẫn trả lời câu hỏi
Đều có 1 lớp electron nhưng nguyên tử He có điện tích hạt nhân +2 lớn hơn nguyên tử H (điện tích hạt nhân là +1) nên hút electron lớp ngoài cùng mạnh hơn, làm cho bán kính của He nhỏ hơn bán kính của H.
Mặt khác, nguyên tử He chỉ có 1 lớp electron nên bán kính là nhỏ nhất trong bảng tuần hoàn.
Câu 3 Luyện tập Trang 41 Hóa 10 Cánh diều
Không dùng bảng độ âm điện, hãy so sánh độ âm điện của nguyên tố X có Z = 14 và nguyên tố Y có Z = 16. Giải thích.
Hướng dẫn trả lời câu hỏi
Bước 1: Viết cấu hình electron, xác định vị trí của X và Y
X (Z = 14): 1s22s22p63s23p2
Y (Z = 16): 1s22s22p63s23p4
⟹ X và Y thuộc chu kì 3.
Bước 2: So sánh độ âm điện của X và Y
Điện tích hạt nhân của X nhỏ hơn Y ⟹ bán kính nguyên tử của X lớn hơn Y
⟹ Độ âm điện của X nhỏ hơn Y
Câu 4 Luyện tập Trang 42 Hóa 10 Cánh diều
Giải thích nguyên nhân của quy luật biến đổi tính phi kim trong một chu kì, một nhóm.
Hướng dẫn trả lời câu hỏi
Trong một chu kì, từ trái sáng phải, điện tích hạt nhân tăng dần thì bán kính nguyên tử giảm dần nên lực hút của hạt nhân tới electron tăng, dẫn đến tăng khả năng nhận electron.
Suy ra, tính phi kim của nguyên tố tăng dần.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân nhưng do bán kính nguyên tử nguyên tố tăng nhanh thì lực hút của hạt nhân tới electron giảm, dẫn đến giảm khả năng nhận electron.
Suy ra, tính phi kim của nguyên tố giảm dần.
Câu 5 Luyện tập Trang 42 Hóa 10 Cánh diều
Sắp xếp các nguyên tố sau theo chiều tăng dần tính phi kim: O, S, F. Giải thích
Hướng dẫn trả lời câu hỏi
O (Z = 8): chu kì 2 nhóm VIA
S (Z = 16): chu kì 3 nhóm VIA
F (Z = 9): chu kì 2 nhóm VIIA
O và F cùng ở chu kì 2, theo chiều tăng của Z tính phi kim của O < F
O và S cùng thuộc nhóm VIA, theo chiều tăng của Z tính phi kim của O > S
Vậy tính phi kim tăng dần từ trái sang phải là S < O < F
Câu 6 Luyện tập Trang 44 Hóa 10 Cánh diều
Xác định nguyên tố có tính kim loại mạnh nhất, nguyên tố có tính phi kim mạnh nhất. Giải thích.
Hướng dẫn trả lời câu hỏi
Dựa vào quy luật biến đổi tính chất hoá học của các nguyên tố trong một chu kì, một nhóm A ta có:
+ Kim loại mạnh nhất là nguyên tố Xesi (Cs) (lưu ý: Fr là nguyên tố phóng xạ)
+ Phi kim mạnh nhất là nguyên tố flo (F).
Câu 7 Luyện tập Trang 44 Hóa 10 Cánh diều
Viết công thức các hydroxide (nếu có) của những nguyên tố chu kì 2. So sánh tính acid, tính base của chúng.
Hướng dẫn trả lời câu hỏi
Nguyên tố chu kì 2 gồm: Li, Be, B, C, N, O, F và Ne.
Li và Be là kim loại nên hydroxide của chúng là: LiOH và Be(OH)2.
Tính acid của LiOH < Be(OH)2, tính base của LiOH > Be(OH)2
C. Giải bài tập trang 45 SGK Hóa 10 Cánh diều
Bài 1 trang 45 Hóa 10 Cánh diều
Hoàn thành chỗ trống trong các câu sau:
a) Trong một chu kì, theo chiểu ... (1)... điện tích hạt nhân, độ âm điện của các nguyên tố có xu hướng tăng dần, tính base của các hydroxide ... (2)... dần.
b) Trong một nhóm, theo chiều ... (3)... điện tích hạt nhân, bán kính các nguyên tử có xu hướng giảm dần, tính acid của các oxide cao nhất ... (4)... dần.
c) Nhóm ...(5)... là nhóm chứa các nguyên tố đứmg đầu mỗi chu kì trong bảng tuần hoàn. Trong nhóm này, nguyên tử nguyên tố ...(6)... có bán kính lớn nhất. Số lượng các nguyên tố là kim loại của nhóm này là ...(7)...
Hướng dẫn giải bài tập
(1) tăng
(2) giảm
(3) tăng ;
(4) giảm
(5) IA;
(6) Cs;
(7) 5
Bài 2 trang 45 Hóa 10 Cánh diều
Những đặc trưng nào sau đây thuộc về kim loại nhóm A, những đặc trưng nào thuộc về phi kim?
(1) Dễ nhường electron
(2) Dễ nhận electron
(3) Oxide cao nhất có tính base
(4) Oxide cao nhất có tính acid
Hướng dẫn giải bài tập
- Đặc trưng của kim loại là:
(1) Dễ nhường electron
(3) Oxide cao nhất có tính base
- Đặc trưng của phi kim là:
(2) Dễ nhận electron
(4) Oxide cao nhất có tính acid.
Bài 3 trang 45 Hóa 10 Cánh diều
Trong hai phản ứng sau, phản ứng nào xảy ra, phản ứng nào không xảy ra? Giải thích.
a) H3PO4 + Na2SO4 → ?
b) HNO3 + Na2CO3 → ?
Hướng dẫn giải bài tập
a) H2SO4 có tính acid mạnh hơn H3PO4 => Phản ứng không xảy ra
b) H2CO3 có tính acid yếu hơn HNO3 => Phản ứng xảy ra:
HNO3 + Na2CO3 → NaNO3 + H2O + CO2
Bài 4 trang 45 Hóa 10 Cánh diều
Cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 như sau:

a) Sự lặp lại tuần hoàn về cấu hình electron lớp ngoài cùng của các nguyên tố ở chu kì 2 và 3 thể hiện như thế nào?
b*) Giải thích vì sao sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng là nguyên nhân quyết định đến sự biến đổi tuần hoàn về tính chất hóa học của các đơn chất và hợp chất các nguyên tố chu kì 2 và 3. Lấy một số ví dụ để minh họa sự biến đổi tính chất hóa học của đơn chất và hợp chất.
>> Bài tiếp theo: Giải Hóa 10 Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
---------------------------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa 10 bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm Cánh diều. Ngoài ra, các em học sinh có thể tham khảo môn: Vật Lý 10 Cánh Diều và Toán 10 Cánh Diều Tập 1, Toán 10 Cánh Diều Tập 2, Sinh 10 Cánh Diều đầy đủ khác.
Hãy tham gia ngay chuyên mục Hỏi đáp các lớp của VnDoc. Đây là nơi kết nối học tập giữa các bạn học sinh với nhau, giúp nhau cùng tiến bộ trong học tập. Các bạn học sinh có thể đặt câu hỏi tại đây:
- Truy cập ngay: Hỏi - Đáp học tập
Hỏi đáp, thảo luận và giao lưu về Toán, Văn, Hóa, Lý, Sinh, Tiếng Anh,... từ Tiểu Học đến Trung học phổ thông nhanh nhất, chính xác nhất.










