Đề thi học sinh giỏi lớp 12 THPT tỉnh Đăk Nông năm học 2010 - 2011 môn Hóa học
Nhằm giúp các bạn chuẩn bị thật tốt kiến thức để làm bài thi đạt hiệu quả cao, Vndoc.com xin giới thiệu: Đề thi học sinh giỏi lớp 12 THPT tỉnh Đăk Nông năm học 2010 - 2011 môn Hóa học.
Đề thi học sinh giỏi môn Hóa học:
SỞ GIÁO DỤC VÀ ĐÀO TẠO
|
ĐỀ THI CHỌN HỌC SINH GIỎI CẤP TỈNH LỚP 12 THPT
|
MÔN THI: HÓA HỌC
Thời gian làm bài: 180 phút (không kể thời gian giao đề)
--------------------------------------------------------------------------------
Bài1: (2,0 điểm)
Hợp chất Y có công thức MX2 trong đó M chiếm 46,667 % về khối lượng. Trong hạt nhân M có số nơtron nhiều hơn số proton là 4 hạt. Trong hạt nhân của X có số nơtron bằng số proton. Tổng số proton trong MX2 là 58.
a) Xác định công thức phân tử của MX2.
b) Hoàn thành các phương trình phản ứng sau từ MX2 đã biết và cân bằng phương trình theo phương pháp thăng bằng electron:
![]()
Bài 2: (2,0 điểm)
1. Tính pH của dung dịch A tạo thành khi cho 0,82g natri axetat vào 1 lit dung dịch axit axetic 0,1 mol/l. Coi như thể tích dung dịch không thay đổi. Biết KCH3COOH = 1,8.10-5
2. Phải thêm bao nhiêu gam natri hiđroxit (rắn) vào dung dịch A để làm pH tăng 1 đơn vị.
Bài 3: (2,0 điểm)
1. Cho phương trình hóa học của phản ứng tổng hợp amoniac: ![]() . Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận tăng hay giảm bao nhiêu lần?
. Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận tăng hay giảm bao nhiêu lần?
2. Cho phản ứng đơn giản ở trạng thái khí: A + αB -> ABα. Xác định biết rằng khi tăng nồng độ của A và B gấp 2 lần thì tốc độ phản ứng tăng gấp 16 lần.
Bài 4: (2,0 điểm)
Để nghiên cứu cân bằng sau ở 250C: ![]() . Người ta chuẩn bị một dung dịch gồm CuSO4 0,5M; FeSO4 0,025M; Fe2(SO4)3 0,125M
. Người ta chuẩn bị một dung dịch gồm CuSO4 0,5M; FeSO4 0,025M; Fe2(SO4)3 0,125M
1. Cho biết chiều của phản ứng?
2. Tính tỉ lệ 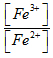 để phản ứng đổi chiều?
để phản ứng đổi chiều?
Cho ![]()
Bài 5: (2,0 điểm)
Một hỗn hợp A gồm Ba và Al. Cho m gam A tác dụng với H2O dư, thu được 1,344 lít khí (đktc), dung dịch B và phần không tan C. Cho 2m gam A tác dụng với dung dịch Ba(OH)2 dư thu được 20,832 lít khí (đktc). Biết các phản ứng xảy ra hoàn toàn.
1. Tính khối lượng từng kim loại trong m gam A.
2. Cho 50ml dung dịch HCl vào dung dịch B. Sau khi phản ứng xong, thu được 0,78 gam kết tủa. Xác định nồng độ mol/l của dung dịch HCl.
Bài 6: (2,0 điểm)
Cho 20,80 gam hỗn hợp Fe, FeS, FeS2, S tác dụng với dung dịch HNO3 đặc nóng dư thu được V lít khí NO (là sản phẩm khử duy nhất, đo ở đktc) và dung dịch A. Cho A tác dụng với dung dịch Ba(OH)2 dư thu được 91,30 gam kết tủa. Tính V?
Bài 7: (2,0 điểm)
1. Viết tất cả các đồng phân mạch hở không làm mất màu nước Brom, có công thức phân tử là C3H6O3.
2. A, B, C, D có cùng công thức phân tử C4H6O4 đều phản ứng với NaOH theo tỉ lệ mol 1:2.
Trong đó:
- A, B đều tạo một muối và một ancol.
- C, D đều tạo một muối, một ancol và nước.
Biết rằng khi đốt cháy muối do A, C tạo ra thì trong sản phẩm cháy không có nước. Xác định A, B, C, D và viết phương trình hoá học biểu diễn phản ứng xảy ra với NaOH.
Bài 8: (2,0 điểm)
Đốt cháy 1,7 gam este X cần 2,52 lít O2 (đktc), chỉ sinh ra CO2 và H2O với tỉ lệ số mol CO2:H2O = 2:1. Đun nóng 0,01mol X với dung dịch NaOH thấy 0,02 mol NaOH tham gia phản ứng. X không có chức ete, không phản ứng với Na trong điều kiện bình thường và không khử được AgNO3 trong dung dịch NH3 ngay cả khi đun nóng. Hãy xác định công thức phân tử và công thức cấu tạo của X, biết MX <140.
Bài 9: (2,0 điểm)
1. Viết phương trình phản ứng điều chế xenlulozơ điaxetat và xenlulozơ triaxetat từ xenlulozơ và anhiđrit axetic có mặt H2SO4, biết phản ứng còn sinh ra axit axetic.
2. Hãy sắp xếp các chất: amoniac, p-nitroanilin, metylamin, đimetylamin, p- metylanilin theo trình tự lực bazơ tăng dần từ trái qua phải. Giải thích ngắn gọn cách sắp xếp đó.
Bài 10: (2,0 điểm)
A là hợp chất hữu cơ chứa C, H, O. Đốt cháy hoàn toàn 3,08 gam A. Hấp thụ toàn bộ sản phẩm thu được vào bình đựng 5000 ml dung dịch Ca(OH)2 0,02M thấy xuất hiện 6 gam kết tủa, phần nước lọc có khối lượng lớn hơn dung dịch Ca(OH)2 ban đầu là 1,24 gam.
a) Viết công thức phân tử của A biết rằng khối lượng mol phân tử của A nhỏ hơn khối lượng mol phân tử của glucozơ.
b) Biết A phản ứng được với NaOH theo tỉ lệ mol A và NaOH là 1:4; A có phản ứng tráng gương. Xác định công thức cấu tạo của A và viết phương trình hoá học xảy ra của các phản ứng trên



