Đề thi học sinh giỏi thành phố Đà Nẵng môn Hóa lớp 10 năm học 2010 - 2011 (Có đáp án)
Vndoc.com xin gửi đến các bạn: Đề thi học sinh giỏi thành phố Đà Nẵng môn Hóa lớp 10 năm học 2010 - 2011 (Có đáp án).
Đề thi học sinh giỏi môn Hóa:
| SỞ GIÁO DỤC VÀ ĐÀO TẠO THÀNH PHỐ ĐÀ NẴNG (Đề thi chính thức) |
KỲ THI CHỌN HỌC SINH GIỎI THÀNH PHỐ NĂM HỌC: 2010 - 2011 Môn: HÓA HỌC LỚP 10 Thời gian: 150 phút (không kể thời gian giao đề) |
Câu I: (2,0 điểm)
1. Một mẩu than lấy từ hang động ở vùng núi đá vôi tỉnh Hòa Bình có 9,4 phân hủy 14C. Hãy cho biết người Việt cổ đại đã tạo ra mẩu than đó cách đây bao nhiêu năm? Biết chu kỳ bán hủy của 14C là 5730 năm, trong khí quyển có 15,3 phân hủy 14C. Các số phân hủy nói trên đều tính với 1,0 gam cacbon, xảy ra trong 1,0 giây.
2. Cho các trị số góc liên kết: 100,3o; 97,8o; 101,5o; 102o và các góc liên kết IPI; FPF; ClPCl; BrPBr. Hãy gán trị số cho mỗi góc liên kết và giải thích (dựa vào độ âm điện).
3. X và Y là 2 nguyên tố nhóm A, đều tạo hợp chất với hiđro có dạng RH (R là kí hiệu của nguyên tố X hoặc Y). Gọi A và B lần lượt là hiđroxit ứng với hóa trị cao nhất của X và Y. Trong B, Y chiếm 22,977% khối lượng. Trung hòa hoàn toàn 50 gam dung dịch A 16,8% cần 150 mL dung dịch B 1 mol/L. Xác định tên của X và Y.
4. Cation M2+ có cấu hình e ở phân lớp ngoài cùng là 3d6, anion X- có cấu hình e ở phân lớp ngoài cùng là 3p6.
a) Viết cấu hình e nguyên tử của các nguyên tố M, X và gọi tên chúng.
b) Viết các phương trình hóa học xảy ra khi cho đơn chất của X lần lượt tác dụng với: MX2, MBr2, MSO4 , Na3MnO4 (dạng huyền phù), NaOH (đun nóng).
Câu II: (2,0 điểm)
1. Cho 6,000 g mẫu chất chứa Fe3O4, Fe2O3 và các tạp chất trơ. Hòa tan mẫu vào luợng dư dung dịch KI trong môi trường H2SO4 (khử tất cả Fe3+ thành Fe2+) tạo ra dung dịch A. Pha loãng dung dịch A đến thể tích 50 mL. Lượng I2 có trong 10 mL dung dịch A phản ứng vừa đủ với 5,500 mL dung dịch KOH 1,00M (sinh ra muối iodua và iodat). Lấy 25 mL mẫu dung dịch A khác, chiết tách I2, lượng muối Fe2+ trong dung dịch còn lại phản ứng vừa đủ với 3,20 mL dung dịch KMnO4 1,000M trong H2SO4.
a) Viết các phương trình hóa học xảy ra.
b) Tính phần trăm khối lượng Fe3O4 và Fe2O3 trong mẫu ban đầu.
2. a) Viết phương trình hóa học chứng tỏ Cl2 có thể oxi hóa Br2 trong môi trường trung tính.
b) Viết phương trình chứng tỏ I2 có thể khử được HNO3, KClO3
c) Bổ sung và cân bằng các phản ứng sau theo phương pháp cân bằng electron:
(1) KClO3 + H2C2O4 + H2SO4 -> ClO2 + ? + ? + ?
(2) FeCl2 + K2Cr2O7 + H2SO4 -> ? + ? + ? + ? + ?
d) Thực hiện phản ứng (1) trong câu (c) là cách tốt nhất để điều chế ClO2. Giải thích vì sao người ta thường chọn H2C2O4 để làm chất khử trong phản ứng này ?
Câu III: (1,75 điểm)
1. Cho phản ứng bậc một: (1) SO2Cl2 (k) -> SO2 (k) + Cl2 (k) Hằng số tốc độ của phản ứng (1) ở 3200C là 2.10-5 s-1. Hỏi có bao nhiêu % SO2Cl2 bị phân hủy khi đun nóng nó ở nhiệt độ trên trong thời gian 1 giờ.
2. Nêu biện pháp làm tăng hiệu suất quá trình tổng hợp NH3, CaO trên lý thuyết từ các cân bằng sau và giải thích vắn tắt.
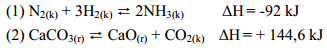
3. Ở 250C, áp suất thấp, NH4HS phân li theo cân bằng sau: NH4HS (r) ⇄ NH3(k) + H2S(k)
Ở trạng thái cân bằng: PNH3.PH2S = 0,109 (PNH3.PH2S là áp suất riêng phần của NH3, H2S ở trạng thái cân bằng).
a) Hãy xác định áp suất chung của hệ nếu ban đầu chỉ đưa NH4HS rắn vào bình chân không.
b) Nếu ban đầu đưa vào bình chân không một lượng NH4HS rắn và khí NH3, khi đạt tới cân bằng thì PNH3 = 0,549 atm. Tính áp suất khí NH3 trong bình trước khi phản ứng xảy ra tại 25oC.
Câu IV: (1,25 điểm)
1. Xác định năng lượng phân li liên kết trung bình của một liên kết C-H trong phân tử CH4 biết nhiệt hình thành chuẩn của CH4 = -74,8 kJ/mol, nhiệt thăng hoa của than chì bằng 716,7 kJ/mol và năng lượng phân li phân tử H2 là 436 kJ/mol.
2. Cho các dữ liệu sau:
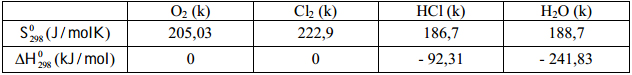
Tính hằng số cân bằng của phản ứng: 4HCl (k) + O2 (k) ⇄ 2Cl2 (k) + 2H2O (k).
Câu V: (3,0 điểm)
1. Viết phương trình hóa học xảy ra khi cho HCl đặc lần lượt tác dụng với: K2Cr2O7, BaO2 (bari supeoxit), Cu2O và LiH. Nêu vai trò của HCl trong các phương trình đó.
2. a) Một nguyên tố R tạo được 4 axit trong đó R thể hiện số oxi hóa +1, +3, +5, +7. Phân tử khối của axit mà R có số oxi hóa +7 gấp 1,9143 lần phân tử khối của axit mà R có số oxi hóa +1. Xác định công thức phân tử, viết công thức cấu tạo của 4 axit và gọi tên.
b) So sánh tính axit và tính oxi hóa của 4 axit, giải thích.
3. Cho dung dịch chứa 6,79 gam hỗn hợp gồm 2 muối KX, KY (X,Y là 2 nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu ZX < ZY) vào dung dịch AgNO3 dư thu được 8,61 gam kết tủa. Tính % khối lượng của KX trong hỗn hợp.



