Cách đọc bảng tuần hoàn hóa học lớp 7
Bảng tuần hoàn hóa học lớp 7
Bảng tuần hoàn hóa học là công cụ quan trọng giúp học sinh lớp 7 hiểu sâu về các nguyên tố hóa học. Trong bài viết này, chúng ta sẽ cùng tìm hiểu cách đọc bảng tuần hoàn, cách xác định chu kỳ – nhóm – số hiệu nguyên tử, cùng những mẹo ghi nhớ đơn giản và hiệu quả nhất
1. Bảng tuần hoàn các nguyên tố hóa học
Bảng tuần hoàn hóa học hay còn được gọi là bảng tuần hoàn Mendeleev, là phương pháp dạng bảng hiển thị lên các nguyên tố hóa học phát minh vào năm 1869 do nhà hóa học Dimitri Mendeleev người Nga.
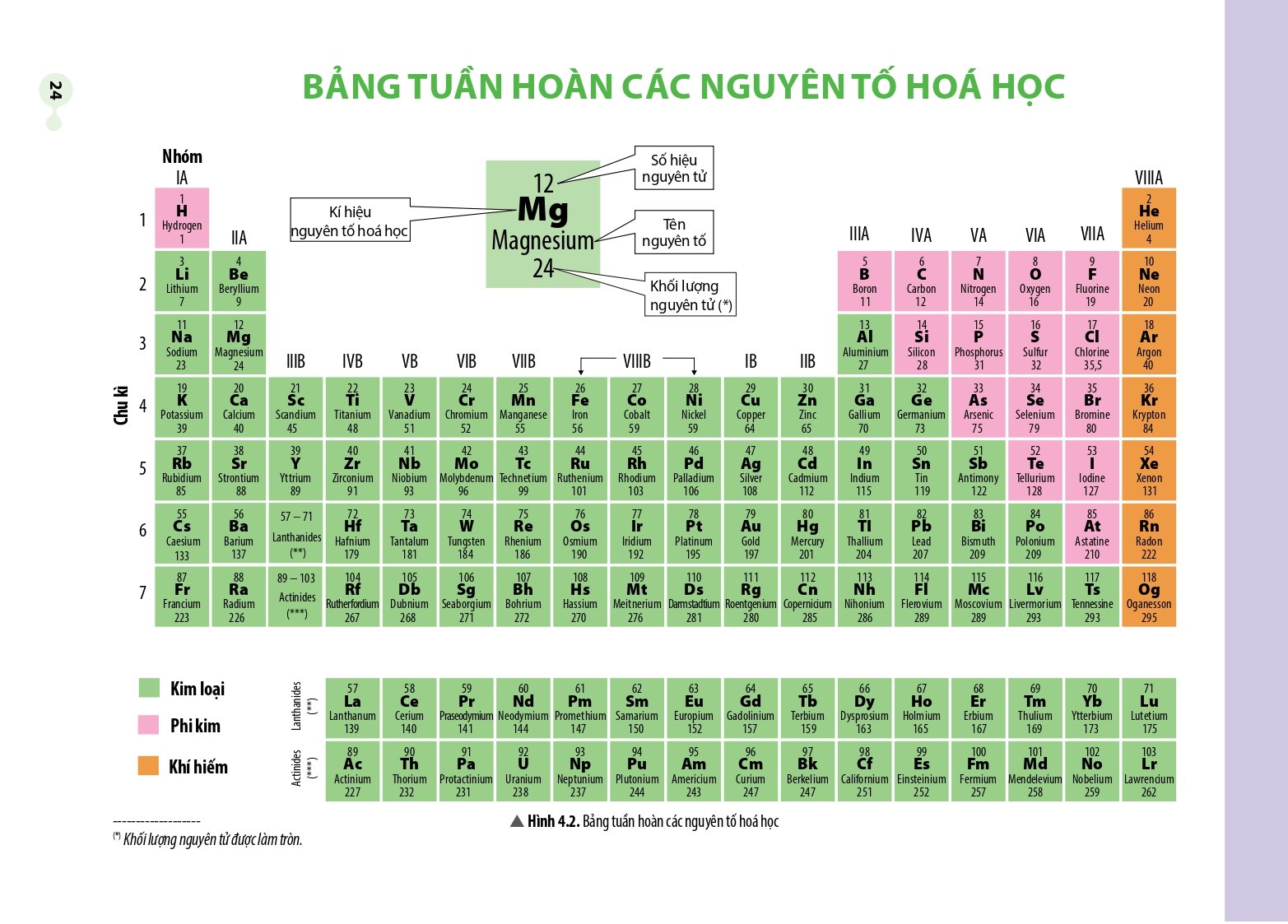
Bảng tuần hoàn hóa học biểu thị nguyên tố hóa học theo cách sắp xếp số hiệu nguyên tử của nguyên tố, cấu hình electron và quy luật tuần hoàn khác. Giá trị của bảng tuần hoàn hóa học là có thể tính toán tính chất hóa học của một nguyên tố dựa trên vị trí của nó.
2. Cách đọc bảng tuần hoàn hóa học
2.1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
Cơ sở chính để sắp xếp các nguyên tố hóa học vào bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn) là dựa vào điện tích hạt nhân nguyên tử.
Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn:
+ Các nguyên tố hóa học được sắp xếp theo chiều tăng dần điện tích hạt nhân của nguyên tử.
+ Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
+ Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành một cột
2.2. Mô tả cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bảng tuần hoàn gồm các nguyên tố hóa học mà vị trí được đặc trưng bởi ô nguyên tố, chu kì và nhóm.
Các nguyên tố họ lanthanide và họ actinide được xếp riêng thành 2 hàng ở cuối bảng tuần hoàn.
- Ô nguyên tố
Trong bảng tuần hoàn, mỗi ô nguyên tố cho biết các thông tin cần thiết về một nguyên tố hóa học.
Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân (bằng số proton trong hạt nhân) và bằng số electron của nguyên tử.
Số hiệu nguyên tử cũng là số thứ tự của nguyên tố trong bảng tuần hoàn.
Ví dụ: Dựa vào ô nguyên tố số 12 trong bảng tuần hoàn ta biết được:
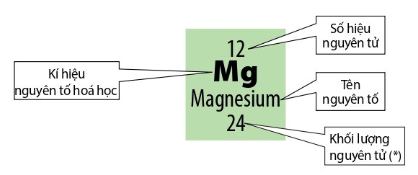
+ Số hiệu nguyên tử: 12
+ Kí hiệu hóa học: Mg
+ Tên nguyên tố: Magnesium
+ Khối lượng nguyên tử: 24 amu
+ Ngoài ra:
Điện tích hạt nhân = +12.
Số đơn vị điện tích hạt nhân = số proton = số electron = 12
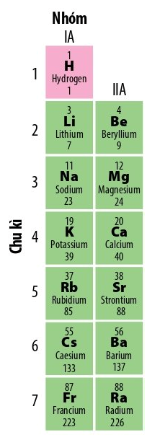
- Chu kì trong bảng tuần hoàn các nguyên tố hóa học
Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được sắp xếp vào cùng một hàng ngang trong bảng tuần hoàn được gọi là chu kì.
Hiện nay, bảng tuần hoàn gồm có 7 chu kì, xét về số lượng các nguyên tố trong mỗi chu kì thì chu kì được chia thành:
+ Chu kì nhỏ gồm các chu kì 1, 2, 3.
+ Chu kì lớn gồm các chu kì 4, 5, 6, 7.
Số thứ tự chu kì = số lớp electron.
- Nhóm trong bảng tuần hoàn các nguyên tố hóa học
Nhóm là tập hợp các nguyên tố có tính chất hóa học tương tự nhau và được xếp thành cột, theo chiều tăng dần về điện tích hạt nhân.
Số thứ tự nhóm được kí hiệu bằng các chữ số La Mã từ I đến VIII.
Ví dụ:

+ Nhóm IA gồm các nguyên tố kim loại hoạt động mạnh (trừ H). Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ Li (+3) đên Fr (+87).
+ Nhóm VIIA gồm các nguyên tố phi kim hoạt động mạnh (trừ At, Ts). Nguyên tử của chúng đều có 7 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ F (+9) đến Ts (+117).
- Các nguyên tố kim loại
Các nguyên tố kim loại nhóm A
Các nguyên tố kim loại nhóm A gồm nhóm IA (trừ nguyên tố hydrogen); nhóm IIA, nhóm IIIA (trừ nguyên tố boron), …
+ Các nguyên tố kim loại thuộc nhóm IA được gọi là nhóm kim loại kiềm.
+ Các nguyên tố kim loại thuộc nhóm IIA được gọi là nhóm kim loại kiềm thổ.
Các nguyên tố kim loại nhóm B
Các nguyên tố nhóm B đều là kim loại, mỗi nhóm B tương ứng với một cột trong bảng tuần hoàn (trừ nhóm VIIIB có 3 cột).
- Các nguyên tố phi kim
Nhóm nguyên tố phi kim chủ yếu tập trung ở góc bên phải của bảng tuần hoàn các nguyên tố hóa học. Các nguyên tố phi kim bao gồm:
+ Nguyên tố hydrogen ở nhóm IA.
+ Một số nguyên tố ở nhóm IIIA và IVA.
+ Hầu hết các nguyên tố thuộc nhóm VA, VIA và VIIA.
3. Bảng phiên âm tên gọi 20 nguyên tố Hóa học theo Quốc tế
|
Số hiệu nguyên tử (Z) |
Kí hiệu hóa học |
Tên nguyên tố hóa học |
Phiên âm Quốc tế |
|
1 |
H |
Hydrogen |
/ˈhaɪdrədʒən/ |
|
2 |
He |
Helium |
/ˈhiːliəm/ |
|
3 |
Li |
Lithium |
/ˈlɪθiəm/ |
|
4 |
Be |
Beryllium |
/bəˈrɪliəm/ |
|
5 |
B |
Boron |
/ˈbɔːrɒn/ /ˈbɔːrɑːn/ |
|
6 |
C |
Carbon |
/ˈkɑːbən/ /ˈkɑːrbən/ |
|
7 |
N |
Nitrogen |
/ˈnaɪtrədʒən/ |
|
8 |
O |
Oxygen |
/ˈɒksɪdʒən/ /ˈɑːksɪdʒən/ |
|
9 |
F |
Fluorine |
/ˈflɔːriːn/ /ˈflʊəriːn/ /ˈflɔːriːn/ /ˈflʊriːn/ |
|
10 |
Ne |
Neon |
/ˈniːɒn/ /ˈniːɑːn/ |
|
11 |
Na |
Sodium |
/ˈsəʊdiəm/ |
|
12 |
Mg |
Magnesium |
/mæɡˈniːziəm/ |
|
13 |
Al |
Aluminium |
/ˌæljəˈmɪniəm/ /ˌæləˈmɪniəm/ /ˌæljəˈmɪniəm/ /ˌæləˈmɪniəm/ |
|
14 |
Si |
Silicon |
/ˈsɪlɪkən/ |
|
15 |
P |
Phosphorus |
/ˈfɒsfərəs/ /ˈfɑːsfərəs/ |
|
16 |
S |
Sulfur |
/ˈsʌlfə(r)/ /ˈsʌlfər/ |
|
17 |
Cl |
Chlorine |
/ˈklɔːriːn/ |
|
18 |
Ar |
Argon |
/ˈɑːɡɒn/ /ˈɑːrɡɑːn/ |
|
19 |
K |
Potassium |
/pəˈtæsiəm/ |
|
20 |
Ca |
Calcium |
/ˈkælsiəm/ |
4. Câu hỏi thường gặp về bảng tuần hoàn
Câu 1. Cho biết các nguyên tử của nguyên tố M có 3 lớp electron và có 1 electron ở lớp ngoài cùng. Nguyên tố M có vị trí trong bảng tuần hoàn như sau:
A. ô số 9, chu kì 3, nhóm IA.
B. ô số 10, chu kì 2, nhóm IA.
C. ô số 12, chu kì 3, nhóm IA.
D. ô số 11, chu kì 3, nhóm IA.
M có 3 lớp electron nên thuộc chu kì 3 ⇒ Loại đáp án B.
M có 1 electron ở lớp ngoài cùng nên thuộc nhóm IA.
M có 3 lớp electron trong đó: lớp thứ nhất có 2 electron, lớp thứ hai có 8 electron, lớp thứ 3 có 1 electron ⇒ M có 11 electron. Vậy M thuộc ô 11 trong bảng tuần hoàn.
Câu 2. Cho biết một nguyên tử của nguyên tố X có điện tích hạt nhân là +17. Hãy chọn câu đúng trong các câu sau:
A. Nguyên tố X ở chu kì 3, nhóm VIIA; là phi kim; có 17 proton, 7 electron.
B. Nguyên tố X ở chu kì 3, nhóm VIIA; là phi kim; có 17 proton, 17 electron.
C. Nguyên tố X ở chu kì 2, nhóm VIIA; là kim loại; có 17 proton, 17 electron.
D. Nguyên tố X ở chu kì 2, nhóm VIIA; là phi kim; có 17 proton, 7 electron.
- X có điện tích hạt nhân là +17 nên nguyên tử X có 17 proton và 17 electron (loại đáp án A và D).
- X có 17 electron được phân vào 3 lớp, vậy X thuộc chu kì 3 (loại đáp án C).
Câu 3. Phát biểu nào sau đây là đúng?
A. Bảng tuần hoàn gồm 116 nguyên tố hóa học.
B. Bảng tuần hoàn gồm 6 chu kì.
C. Bảng tuần hoàn gồm 8 nhóm A và 8 nhóm B.
D. Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
A sai vì bảng tuần hoàn hiện tại có 118 nguyên tố hóa học.
B sai vì bảng tuần hoàn hiện tại có 7 chu kì.
D sai vì hiện tại các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
Câu 4. Phát biểu nào sau đây không đúng?
A. Bảng tuần hoàn gồm 3 chu kì nhỏ và 4 chu kì lớn.
B. Số thứ tự của chu kì bằng số electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc chu kì đó.
C. Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố thuộc chu kì đó.
D. Các nguyên tố trong cùng chu kì được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Phát biểu B không đúng vì, số thứ tự của chu kì bằng số lớp electron.
Câu 5. Phát biểu nào sau đây là đúng?
A. Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau và được xếp vào cùng một hàng.
B. Các nguyên tố thuộc cùng một nhóm có tính chất gần giống nhau.
C. Bảng tuần hoàn gồm 8 nhóm được kí hiệu từ 1 đến 8.
D. Các nguyên tố trong nhóm được xếp thành một cột theo chiều khối lượng nguyên tử tăng dần.
Các nguyên tố thuộc cùng một nhóm có tính chất gần giống nhau.
A. Sai vì: Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau và được xếp vào cùng một cột.
B. Sai vì: Bảng tuần hoàn gồm 8 nhóm A được đánh số từ IA đến VIIIA và 8 nhóm B được đánh số từ IB đến VIIIB.
D. Sai vì: Các nguyên tố trong nhóm được xếp thành một cột theo chiều điện tích hạt nhân tăng dần.
Chi tiết bộ câu hỏi nằm trong FILE TẢI VỀ









