Đề thi học kì 2 môn Hóa học 10 Kết nối tri thức năm 2023
Đề kiểm tra cuối học kì 2 Hóa học 10 KNTT
Lớp:
Lớp 10
Môn:
Hóa Học
Dạng tài liệu:
Đề thi
Bộ sách:
Kết nối tri thức với cuộc sống
Loại File:
PDF
Phân loại:
Tài liệu Tính phí

SỞ GD&ĐT ……..
TRƯỜNG THPT……………..
(Đề thi gồm có 03 trang)
ĐỀ KIỂM TRA HỌC KỲ II
NĂM HỌC 2022-2023
Môn: Hóa học 10
Thời gian làm bài: 60 phút, không kể thời gian giao
đề
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của carbon trong hợp chất CH
4
là
A. +1.
B. -1.
C. +4.
D. -4.
Câu 2: Cho các hợp chất sau: SO
2
; H
2
SO
4
; Na
2
SO
4
; Na
2
S; CaSO
3
. Số hợp chất trong đó
sulfur có số oxi hoá +4 là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 3: Cho các phản ứng hoá học sau, phản ứng oxi hoá - khử là
A. NaOH + HCl → NaCl + H
2
O.
B. CuO + H
2
SO
4
→ CuSO
4
+ H
2
O.
C. K
2
CO
3
+ 2HCl → 2KCl + CO
2
+ H
2
O.
D. 2KClO
3
t ∘ → →t° 2KCl + 3O
2
.
Câu 4: Cho phản ứng hoá học sau: Fe + 2HCl → FeCl
2
+ H
2
. Chất bị oxi hoá là
A. Fe.
B. HCl.
C. FeCl
2
.
D. H
2
.
Câu 5: Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:

Câu 6: Ở điều kiện chuẩn, nếu đốt cháy 12,395 L khí CO thì nhiệt lượng toả ra là
A. – 852,5 kJ.
B. – 426,25 kJ.
C. 852,5 kJ.
D. 426,25 kJ.
Câu 6: Cho các phương trình nhiệt hoá học sau:
(1) C
2
H
4
(g) + H
2
(g) → C
2
H
6
(g)
(2) Fe
2
O
3
(s) + 2Al(s) → Al
2
O
3
(s) + 2Fe(s)
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
Câu 7: Cho phương trình nhiệt hoá học sau:
N
2
(g) + O
2
(g) → 2NO(g)
Nhiệt tạo thành chuẩn của NO(g) là
A. +180,6 kJ/ mol.
B. –180,6 kJ/ mol.
C. +90,3 kJ/mol.
D. -90,3 kJ/mol.
Câu 8: Nhiệt lượng tỏa ra hay thu vào của phản ứng ở một điều kiện xác định được gọi là
A. biến thiên nhiệt lượng của phản ứng.
B. biến thiên enthalpy của phản ứng.
C. enthalpy của phản ứng.
D. biến thiên năng lượng của phản ứng.
Câu 9: Công thức tính biến thiên enthalpy chuẩn của phản ứng theo năng lượng liên kết là
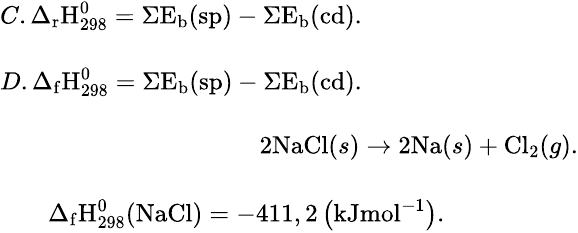
Câu 10: Cho phản ứng:
Biết Biến thiên enthalpy chuẩn của phản ứng này là
A. -822,4 kJ
B. +822,4 kJ.
C. -411,2 kJ
D. +411,2 kJ.
Câu 11: Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào
sau đây?
A. Tốc độ phản ứng.
B. Cân bằng hóa học.
C. Phản ứng một chiều.
D. Phản ứng thuận nghịch.
Câu 12: Cho phản ứng phân hủy N
2
O
5
như sau: 2N
2
O
5
(g) → 4NO
2
(g) + O
2
(g).
Tại thời điểm ban đầu, nồng độ của N
2
O
5
là 0,02M; Sau 100s, nồng độ N
2
O
5
còn 0,0169M.
Tốc độ trung bình của phản ứng phân hủy N
2
O
5
trong 100s đầu tiên là
A. 1,55.10
-5
(mol/ (L.s)).
B. 1,55.10
-5
(mol/ (L.min)).
C. 1,35.10
-5
(mol/ (L.s)).
D. 1,35.10
-5
(mol/ (L.min)).
Câu 13: Cho phản ứng đơn giản sau: 2NO + O
2
→ 2NO
2
. Mối liên hệ giữa tốc độ phản ứng và
nồng độ các chất tham gia phản ứng là
A. 1,55.10
-5
(mol/ L.s))
B. 1,55.10
-5
(mol/ L.min))
C. 1,35.10
-5
(mol/ L.s))
D. 1,35.10
-5
(mol/ L.min))
Câu 14: Việc làm nào dưới đây thể hiện sự ảnh hưởng của diện tích bề mặt đến tốc độ phản
ứng: CaCO
3
(s) + 2HCl(aq) → CaCl
2
(aq) + CO
2
(g) + H
2
O(l)?
A. Pha loãng dung dịch HCl.
B. Nghiền nhỏ đá vôi (CaCO
3
).
Đề thi học kì 2 lớp 10 môn Hóa học Kết nối tri thức năm 2023
VnDoc.com xin gửi tới bạn đọc bài viết Đề thi học kì 2 môn Hóa học 10 Kết nối tri thức năm 2023 để bạn đọc cùng tham khảo và có thêm tài liệu học tập tốt hơn môn Hóa học 10 Kết nối tri thức nhé.
VnDoc.com vừa gửi tới bạn đọc bài viết Đề thi học kì 2 môn Hóa học 10 Kết nối tri thức năm 2023. Hi vọng qua bài viết này bạn đọc có thêm tài liệu ôn thi. Mời các bạn cùng tham khảo thêm tại mục Đề thi học kì 2 lớp 10 môn Hóa học Kết nối...



