10 đề thi Hóa học kì 2 lớp 10 năm 2021- 2022 Có đáp án
10 đề thi Hóa học kì 2 lớp 10 năm 2020 - 2021 được đội ngũ giáo viên VnDoc biên soạn gửi tới các bạn là đề thi học kì 2 Hóa học 10 kèm đáp án. Bộ tài liệu gồm 5 đề kiểm tra với nội dung câu hỏi trắc nghiệm bám sát nội dung đề cương ôn tập học kì 2 Hóa 10.
Đề thi học kì 2 hóa 10 có đáp án
- Đề thi Hóa 10 học kì 2 năm học 2021 - 2022 Có đáp án
- Đề thi Hóa 10 học kì 2 năm học 2021 - 2022 Đề 2
- Đề thi hóa 10 học kì 2 năm học 2021- 2022 Đề 1
- Đề thi hóa 10 học kì 2 năm học 2021 - 2022 Đề 3
Đề cương ôn tập học kì 2 môn Hóa 10
- Chuỗi phản ứng hóa học lớp 10 Chương Halogen
- Các chuỗi phản ứng hóa học lớp 10 Chương Oxi lưu huỳnh
- Đề cương ôn tập môn Hóa học lớp 10 học kì 2
- Đề cương ôn tập Hóa học 10 kì 2 năm 2021 Có đáp án
Hy vọng bộ đề thi học kì 2 Hóa học 10 này sẽ giúp các bạn luyện đề, củng cố kiến thức chuẩn bị tốt cho kì thi cuối kì.
Đề thi Hóa 10 học kì 2 có đáp án
- Đề thi học kì 2 hóa 10 có đáp án
- Đề cương ôn tập học kì 2 môn Hóa 10
- Đề thi Hóa học kì 2 lớp 10 - Đề số 1
- Đáp án đề thi cuối kì 2 lớp 10 môn Hóa học - Đề số 1
- Đề thi Hóa học kì 2 lớp 10 - Đề số 2
- Đáp án đề kiểm tra cuối kì 2 môn Hóa học lớp 10 - Đề số 2
- Đề thi Hóa học kì 2 lớp 10 - Đề số 3
- Đáp án đề kiểm tra cuối kì 2 môn Hóa học 10 - Đề số 3
- Đề thi Hóa học kì 2 lớp 10 - Đề số 4
- Đáp án đề kiểm tra cuối kì 2 môn Hóa học lớp 10 - Đề số 4
- Đề thi Hóa học kì 2 lớp 10 - Đề số 5
- Đáp án đề thi Hóa học kì 2 lớp 10 - Đề số 5
Bản quyền thuộc về VnDoc nghiêm cấm mọi hành vi sao chép vì mục đích thương mại
Đề thi Hóa học kì 2 lớp 10 - Đề số 1
Câu 1. Cho các chất sau: NaOH (1), Mg (2), Ag (3), Al(OH)3 (4), KMnO4 (5), Na2SO4 (6). Những chất nào tác dung được với axit HCl
A. (1), (2), (4), (5).
B. (3), (4), (5), (6).
C. (1), (2), (3), (4).
D. (1), (2), (3), (5).
Câu 2. Chất nào sau đây chỉ có tính oxi hoá, không có tính khử?
A. F2.
B. Cl2.
C. Br2.
D. I2.
Câu 3. Hỗn hợp khí nào sau đây có thể tồn tại cùng nhau?
A. Khí H2S và khí CO2
B. Khí O2 và khí Cl2.
C. Khí O2 và khí H2.
D. Khí NH3 và khí HCl.
Câu 4. Cho các phản ứng:
(1) O3 + dung dịch KI
(2) F2 + H2O
(3) MnO2 + HCl đặc
(4) Cl2 + dung dịch H2S
Các phản ứng tạo ra đơn chất là:
A. (1), (2), (3).
B. (1), (3), (4).
C. (2), (3), (4).
D. (1), (2), (4).
Câu 5. Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư,thu được 32,5 gam FeCl3. Giá trị của m là
A. 14 g
B. 16,8 g
C. 5,6 g
D. 8,4 g
Câu 6. Những phản ứng nào sau đây chứng minh tính oxi hóa của ozon mạnh hơn oxi?
(1) O3 + Ag
(2) O3 + KI + H2O
(3) O3 + Fe
(4) O3 + CH4
A. 1, 2.
B. 2, 3.
C. 2, 4.
D. 3, 4.
Câu 7. SO2 luôn thể hiện tính khử trong các phản ứng với
A. H2S, O2, nước Cl2.
B. dung dịch NaOH, Mg, dung dịch KMnO4.
C. dung dịch KOH, CaO, nước Cl2.
D. H2, nước Cl2, dung dịch KMnO4.
Câu 8. Cho biết tổng hệ số cân bằng phương trình dưới đây
FeO + H2SO4 → H2O + Fe2(SO4)3 + SO2
A. 10
B. 11
C. 12
D. 14
Câu 9. Chọn câu đúng:
A. Có thể nhận biết ion F-, Cl-, Br-, I- chỉ bằng dung dịch AgNO3.
B. Các ion Cl-, Br-, I- đều cho kết tủa màu trắng với Ag+.
C. Các ion F-, Cl-, Br-, I- đều tạo kết tủa với Ag+.
D. Trong các ion halogenua, chỉ có ion Cl- mới tạo kết tủa với Ag+.
Câu 10. Đốt cháy hoàn toàn 18,4 gam hỗn hợp Fe và Mg trong khí Clo dư.Sau phản ứng thu được 61 gam chất rắn.Phần trăm khối lượng của Mg trong hỗn hợp là:
A. 26,09%
B. 39,13 %
C. 52,175
D. 45,65%
Câu 11. Có thể làm khô khí SO2 ẩm bằng dung dịch H2SO4 đặc, nhưng không thể làm khô NH3 ẩm bằng dung dịch H2SO4 đặc vì:
A. NH3 tác dụng với H2SO4.
B. không có phản ứng xảy ra.
C. CO2 tác dụng với H2SO4.
D. phản ứng xảy ra quá mãnh liệt.
Câu 12. Cho bột Fe vào dung dịch H2SO4 đặc, nóng cho đến khi Fe không còn tan được nữa. Sản phẩm thu được trong dung dịch sau phản ứng là:
A. FeSO4.
B. Fe2(SO4)3.
C. FeSO4 và Fe.
D. FeSO4 và Fe2(SO4)3.
Câu 13. Cho 2,6 gam một kim loại M có hóa trị II tác dụng vừa đủ với 0,56 lít hỗn hợp X gồm O2 và Cl2 ở (đktc) sau phản ứng thu được 3,79 gam chất rắn là các oxit và muối. Tìm kim loại M là
A. Ca
B. Cu
C. Mg
D. Zn
Câu 14. Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do
A. Nồng độ của các chất khí tăng lên.
B. Nồng độ của các chất khí giảm xuống.
C. Chuyển động của các chất khí tăng lên.
D. Nồng độ của các chất khí không thay đổi.
Câu 15. Dẫn 11,2 lít khí clo vào 500ml dung dịch chứa hỗn hợp NaBr 1M và NaI 1,2M, sau khi phản ứng xảy ra hoàn toàn đun nóng để cô cạn dug dịch thu được m gam chất rắn khan. Giá trị m là:
A. 141,5 gam
B. 68,8 gam
C. 73,5 gam
D. 58,5 gam
Câu 16. Để phân biệt 2 khí O2 và O3, người ta thường dùng hóa chất nào:
A. nước.
B. dung dịch KI và hồ tinh bột.
C. dung dịch CuSO4.
D. dung dịch H2SO4.
Câu 17. Dung dịch H2S khi để ngoài trời xuất hiện lớp cặn màu vàng là do:
A. Oxi trong không khí đã oxi hóa H2S thành lưu huỳnh tự do.
B. H2S bị oxi không khí khử thành lưu huỳnh tự do.
C. H2S đã tác dụng với các hợp chất có trong không khí.
D. Có sự tạo ra các muối sunfua khác nhau.
Câu 18. Nhiệt phân hoàn toàn 3,16 gam KMnO4,thể tích O2 ở đktc thu được là
A. 336 ml
B. 112 ml
C. 224 ml
D. 448 ml
Câu 19. Oxi hóa hoàn toàn 24,9g hỗn hợp bột các kim loại Mg, Al, Zn bằng oxi thu được 15,3g hỗn hợp oxit. Cho lượng oxit này tác dụng hết với dung dịch HCl thì khối lượng muối tạo ra là
A. 15,6 gam
B. 20,85 gam
C. 15,45 gam
D. 48,3 gam
Câu 20. Kết luận gì có thể rút ra từ 2 phản ứng sau:
(1) SO2 + Cl2 + 2H2O ![]() \(\rightarrow\) H2SO4 + 2HCl
\(\rightarrow\) H2SO4 + 2HCl
(2) SO2 + 2H2S ![]() \(\rightarrow\) 3S + 2H2O
\(\rightarrow\) 3S + 2H2O
A. SO2 là chất khử mạnh.
B. SO2 vừa có tính khử, vừa có tính oxi hóa.
C. SO2 là chất oxi hóa mạnh.
D. SO2 kém bền.
Câu 21. Cho FeS tác dụng với dung dịch H2SO4 loãng, thu được khí A; nếu dùng dung dịch H2SO4 đặc, nóng thì thu được khí B. Dẫn khí B vào dung dịch A thu được rắn C. Các chất A, B, C lần lượt là:
A. H2, H2S, S
B. O2, SO2, SO3.
C. H2, SO2, S.
D. H2S, SO2, S.
Câu 22. Để a gam bột sắt ngoài không khí,sau một thời gian sẽ chuyển thành hỗn hợp A có khối lượng 37,6 gam gồm Fe, FeO,Fe2O3, Fe3O4. Cho hỗn hợp A phản ứng hết với dung dịch H2SO4 đặc, nóng thu được 3,36 lít khí SO2 (đktc). Giá trị a là:
A. 11,2 gam
B. 8,4 gam
C. 56gam
D. 28 gam
Câu 23. Hoà tan hết m gam Al bằng H2SO4 đặc nóng dư thu được 3,36 lít khí SO2 là sản phẩm khử duy nhất,ở đktc. Tính m?
A. 8,1 g
B. 2,7 g
C. 5,4 g
D. 4,05 g
Câu 24. Cho phản ứng sau ở trang thái cân bằng:
H2 (k)+ F2 (k) ![]() \(\rightleftharpoons\) 2HF (k) < 0 Sự biến đổi nào sau đây không làm chuyển dịch cân bằng hoá học?
\(\rightleftharpoons\) 2HF (k) < 0 Sự biến đổi nào sau đây không làm chuyển dịch cân bằng hoá học?
A. Thay đổi áp suất
B. Thay đổi nhiệt độ
C. Thay đổi nồng độ khí H2 hoặc F2
D. Thay đổi nồng độ khí HF
Câu 25. Trường hợp nào sau đây không xảy ra phản ứng hoá học?
A. Sục khí H2S vào dung dịch H2SO4.
B. Cho Fe vào dung dịch H2SO4 đặc, nguội.
C. Sục SO2 vào dung dịch nước Br2.
D. Sục khí Cl2 vào dung dịch FeCl2.
Câu 26. Hơi thủy ngân rất độc, do đó phải thu hồi thủy ngân rơi vãi bằng cách:
A. nhỏ nước brom lên giọt thủy ngân.
B. nhỏ nước ozon lên giọt thủy ngân.
C. rắc bột lưu huỳnh lên giọt thủy ngân.
D. rắc bột photpho lên giọt thủy ngân.
Câu 27. Chỉ ra phát biểu sai:
A. Oxi là nguyên tố phi kim có tính oxi hóa mạnh.
B. Ozon có tính oxi hóa mạnh hơn oxi.
C. Oxi có số oxi hóa –2 trong mọi hợp chất.
D. Oxi là nguyên tố phổ biến nhất trên trái đất.
Câu 28. Hoà tan 20,8 gam hỗn hợp bột gồm FeS, FeS2, S bằng dung dịch HNO3 đặc nóng dư thu được 53,76 lít NO2 (sản phẩm khử duy nhất, ở đktc và dung dịch X. Cho dung dịch X tác dụng với dung dịch NaOH dư, lọc lấy toàn bộ kết tủa nung trong không khí đến khối lượng không đổi thì khối lượng chất rắn thu được là:
A. 16 gam
B. 9 gam
C. 8,2 gam
D. 10,7 gam
Câu 29. Định nghĩa nào sau đây là đúng?
A. Chất xúc tác là chất làm thay đổi tốc độ phản ứng, nhưng không bị tiêu hao trong phản ứng.
B. Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị tiêu hao trong phản ứng.
C. Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị thay đổi trong phản ứng.
D. Chất xúc tác là chất làm thay đổi tốc độ phản ứng, nhưng bị tiêu hao không nhiều trong phản ứng.
Câu 30. Cho 100ml dung dịch KOH 1M tác dụng với 100 ml dung dịch HCl aM, sau phản ứng thu được dung dịch Y có chứa 6,9875 gam chất tan. Vậy giá trị a là
A. 0,75M
B. 0,5M
C. 1,0M
D. 0,25M
Đáp án đề thi cuối kì 2 lớp 10 môn Hóa học - Đề số 1
| 1 A | 2 A | 3D | 4 D | 5 C | 6 A | 7 C | 8 C | 9 B | 10 B |
| 11 A | 12 B | 13 D | 14 A | 15 B | 16 C | 17 A | 18 C | 19 D | 20 B |
| 21 D | 22 D | 23 B | 24 A | 25 B | 26 C | 27 C | 28 A | 29 C | 30 A |
Hướng dẫn giải chi tiết đề thi hóa học kì 2 Lớp 10 - Đề 1
Câu 10.
2Fe + 3Cl2 ⟶ 2FeCl3
Mg + Cl2⟶ MgCl2
Gọi số mol của Fe và Mg lần lượt là x và y
Theo đề bài ta có hệ:
56x + 24y = 18,41
62,5x + 95y = 61
⇔ x = 0,2
y = 0,3
%mFe = 0,2.56/(18,4.100) = 60,87%
%mMg= 100% − 60,87% == 39,13%
Câu 21.
FeS + H2SO4 → FeSO4 + H2S (A)
2FeS + 10H2SO4 đặc → Fe2(SO4)3 + 9SO2 (B)+ 10H2O
2H2S + SO2 → 3S (C) + 2H2O
=> những khí tác dụng được với NaOH là: H2S (A), SO2 (B), S (C)
Câu 22.
A + O2 -----> (Fe, FeO, Fe2O3, Fe3O4) + H2SO4 đặc, nóng --------> Fe2(SO4)3 + SO2 + H2O
Nhìn vào sơ đồ trên ta thấy, trong quá trình trên có sự thay đổi số oxi hóa của Fe, O2 và S
Áp dụng bảo toàn e:
Fe ------> Fe3+ + 3e
a/56 3a/56
O2 + 4e ------> 2O2-
(37,6 - a)/32 (37,6 - a)/8
S+6 + 2e ------> S+4
0,3 → 0,15
Suy ra: 3a/56 = (37,6 - a)/8 + 0,3 → a = 28 (gam)
Câu 28. Quy đổi hỗn hợp thành Fe (x) và S (y)
Ta có m hỗn hợp = 56x + 32y = 320,8 gam
Bảo toàn electron: 3nFe + 6nS = nNO2
=> 3x + 6y = 2,4
x = 0,2 và y = 0,4
Bảo toàn Fe => nFe = 2nFe2O3 => nFe2O3 = x/2 = 0,1
mFe2O3 = 0,1.160 = 16 gam
Câu 30
nKOH = 0,1.1 = 0,1 mol
Gọi nồng độ dung dịch HCl đã dùng là aM → nHCl = 0,1a mol
KOH + HCl → KCl + H2O
Nếu KOH phản ứng hết → khối lượng muối KCl tạo ra là: 0,1.74,5 = 7,45 > 6,9875
→ KOH dư và dung dịch thu được gồm 3 ion K+, Cl−, OH−
nK+ = nKOH = 0,1mol
nCl− =nHCl = 0,1a mol
Áp dụng định luật bảo toàn điện tích:
nK+ =nCl−+ nOH− → nOH− = 0,1 – 0,1a
mchất tan = mK+ + mCl− + mOH− = 0,1.39 + 0,1a.35,5 + (0,1 – 0,1a).17 = 6,9875
→ a = 0,75
Đề thi Hóa học kì 2 lớp 10 - Đề số 2
(Cho Fe = 56; Na = 23; Ca = 40; Mg = 24; Mn = 55; Cu = 64; Al = 27, Zn = 65, S = 32, O = 16; Cl = 35,5; Ag = 108; H = 1)
Câu 1. Trong các nhóm chất nào dưới đây, số oxi hóa của Lưu huỳnh đều là +6
A. H2S, H2SO3, H2SO4
B. K2S, Na2SO3, Na2SO4
C. SO2, SO3, Ba2SO3
D. H2SO4, H2S2O7, CuSO4
Câu 2. Kim loại nào dưới đây bị thụ động với axit H2SO4 đặc nguội
A. Cu, Fe
B. Cr, Zn
C. Fe, Cr
D. Cu, Al
Câu 3. Dãy nào được xếp đúng thứ tự tính axit và tính khử tăng dần?
A. HCl, HBr, HI, HF.
B. HI, HBr, HCl, HF.
C. HCl, HI, HBr, HF.
D. HF, HCl, HBr, HI.
Câu 4. Khi phản ứng thuận nghịch ở trạng thái cân bằng thì nó:
A. Không xảy ra nữa
B. Vẫn tiếp tục xảy ra
C. Chỉ xảy ra theo chiều thuận
D. Chỉ xảy ra theo chiều nghịch
Câu 5. Sục 6,72 lít khí SO2 (đktc) vào dung dịch Br2 dư rồi cho dung dịch thu được phản ứng với dung dịch BaCl2 dư thu được kết tủa có khối lượng
A. 66,9 gam
B. 23,3 gam
C. 34,95 gam
D. 46,6 gam
Câu 6. Sục khí ozon vào dung dịch KI có nhỏ sẵn vài giọt hồ tinh bột, hiện tượng quan sát thấy được là:
A. Dung dịch có màu tím
B. Dung dịch có màu vàng nhạt
C. Dung dịch trong suốt
D. Dung dịch có màu xanh
Câu 7. Dùng loại bình nào sau đây để đựng dung dịch HF?
A. Bình thuỷ tinh màu xanh.
B. Bình thuỷ tinh mầu nâu.
C. Bình thuỷ tinh không màu.
D. Bình nhựa teflon (chất dẻo).
Câu 8. Cho sơ đồ chuyển hóa:
Fe3O4 + dung dịch HI (dư) ![]() \(\overset{}{\rightarrow}\) X + Y + H2O
\(\overset{}{\rightarrow}\) X + Y + H2O
Biết X và Y là sản phẩm cuối cùng của quá trình chuyển hóa. Các chất X và Y là:
A. Fe và I2.
C. FeI2 và I2.
B. FeI3 và FeI2.
D. FeI3 và I2.
Câu 9. Hòa tan 5,6 lít SO2 (đktc) vào 100 ml dung dịch KOH 3,5M. Dung dịch tạo thành có chứa:
A. K2SO3
B. K2SO3, KHSO3
C. KHSO3
D. K2SO3, KOH dư
Câu 10. Cho 11 gam hỗn Al, Fe tác dụng với dung dịch H2SO4 đậm đặc nóng dư thì được 10,08 lít khí SO2 (đktc). Phần trăm khối lượng Al trong hỗn hợp ban đầu là:
A. 38%
B. 49,1 %
C. 50,9%
D. 62%
Câu 11. Cho phản ứng: 2NH3 + 3Cl2 ![]() \(\overset{}{\rightarrow}\) N2 + 6HCl. Trong đó Cl2 đóng vai trò là:
\(\overset{}{\rightarrow}\) N2 + 6HCl. Trong đó Cl2 đóng vai trò là:
A. Chất khử.
B. Vừa là chất oxi hoá vừa là chất khử.
C. Chất oxi hoá.
D. Không phải là chất khử hoặc chất oxi hoá.
Câu 12. Trong các phản ứng sau đây, hãy chỉ ra phản ứng không đúng?
A. H2S + 2NaCl → Na2S + 2HCl.
B. 2H2S + 3O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2SO2 + 2H2O.
\(\overset{t^{\circ } }{\rightarrow}\) 2SO2 + 2H2O.
C. H2S + Pb(NO3)2 → PbS + 2HNO3.
D. H2S + 4H2O + 4Br2 ![]() \(\rightarrow\) H2SO4 + 8HBr.
\(\rightarrow\) H2SO4 + 8HBr.
Câu 13. Cho FeS tác dụng với dung dịch H2SO4 loãng, thu được khí A; nếu dùng dung dịch H2SO4 đặc, nóng thì thu được khí B. Dẫn khí B vào dung dịch A thu được rắn C. Các chất A, B, C lần lượt là:
A. H2, H2S, S.
B. H2S, SO2, S.
C. H2, SO2, S.
D. O2, SO2, SO3.
Câu 14. Thể tích khí thu được sau phản ứng khi cho 4,8 gam đồng tác dụng với axit H2SO4 đặc nóng
A. 1,68 lít
B. 2,24 lít
C. 3,36 lít
D. 1,12 lít
Câu 15. 14,5 gam hỗn hơp Mg, Fe, Zn tác dụng vừa đủ với dung dịch H2SO4 loãng thấy thoát ra 6,72 lít khí H2 (đktc). Sau phản ứng cô cạn thu được khối lượng muối khan là:
A. 34,3 gam
B. 43,3 gam
C. 33,4 gam
A. 33,8 gam
Câu 16. Cho 10 gam dung dịch HCl tác dụng với dung dịch AgNO3 dư thu dược 14,35 gam kết tủa. Tính nồng độ % dung dịch HCl phản ứng là:
A. 50%
B. 15%
C. 35%
D. 36,5%
Câu 17. Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do
A. Nồng độ của các chất khí tăng lên.
B. Nồng độ của các chất khí giảm xuống.
C. Chuyển động của các chất khí tăng lên.
D. Nồng độ của các chất khí không thay đổi.
Câu 18. Hòa tan hoàn toàn 13 gam kim loại A có hóa trị II vào H2SO4 loãng thu được 4,48 lít H2 (đktc). Kim loại A là:
A. Mg
B. Zn
C. Cu
D. Fe
Câu 19. Khi tăng thêm 10oC, tốc độ phản ứng hóa học tăng lên 3 lần. Để tốc độ phản ứng đó (đang tiến hành ở 30oC) tăng 81 lần thì cần phải tăng nhiệt độ lên đến
A. 70oC
B. 80oC
C. 50oC
D. 60oC
Câu 20. Tổng hệ số cân bằng trong phản ứng hóa học sau:
FeO + H2SO4 → Fe2(SO4)3 + SO2 + H2SO4
A. 11
B. 12
C. 13
D. 14
Câu 21. Những phản ứng nào sau đây chứng minh tính oxi hóa của ozon mạnh hơn oxi?
(1) O3 + Ag
(2) O3 + KI + H2O
(3) O3 + Fe
(4) O3 + CH4
A. 1, 2.
B. 2, 3.
C. 2, 4.
D. 3, 4.
Câu 22. Để a gam bột sắt ngoài không khí,sau một thời gian sẽ chuyển thành hỗn hợp A có khối lượng 37,6 gam gồm Fe, FeO, Fe2O3, Fe3O4. Cho hỗn hợp A phản ứng hết với dung dịch H2SO4 đặc nóng thu được 3,36 lít khí SO2 (đktc). Giá trị a là:
A. 11,2 gam
B. 8,4 gam
C. 56 gam
D. 28 gam
Câu 23. Để loại bỏ SO2 ra khỏi CO2 có thể:
A. Cho hỗn hợp khí qua dung dịch nước vôi trong
B. Cho hỗn hợp khí qua dung dịch Na2CO3
C. Cho hỗn hợp khí qua dung dịch nước Br2 dư
D. Cho hỗn hợp qua dung dịch NaOH
Câu 24. Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm ở dạng nào sau đây?
A. Dạng viên nhỏ.
B. Dạng bột mịn, khuấy đều.
C. Dạng tấm mỏng.
D. Dạng nhôm dây.
Câu 25. Trộn 3,6 muối sunfat của kim loại hóa II với 8 gam Fe2(SO4)3. Cho hỗn hợp tác dụng vừa đủ với 100ml dung dịch BaCl2 tạo thành 20,97 g kết tủa trắng. Nồng độ mol/l của dung dịch BaCl2 và tên kim loại đó là
A. 0,54M; Cr
B. 0,65M; Al
C. 0,9M; Mg
D. 0,4M; Cr
Đáp án đề kiểm tra cuối kì 2 môn Hóa học lớp 10 - Đề số 2
| 1 D | 2 C | 3 D | 4 B | 5 A |
| 6 D | 7 D | 8 C | 9 B | 10 B1 |
| 11 C | 12 C | 13 B | 14 C | 15 B |
| 16 D | 17 A | 18 B | 19 A | 20 B |
| 21 A | 22 D | 23 C | 24 B | 25C |
Hướng dẫn giải chi tiết đề thi
Câu 22.
Quy đổi hỗn hợp thành Fe: x mol và O: y mol
Theo phương trình hóa học:
56x + 16y = 37,6 (1)
Fe → Fe3+ + 3e
x → 3x
S+6 + 2e → S+4 O → O-2 + 2e
y → 2y
Áp dụng bảo toàn electron:
3x= 2y + 0,3 (2)
Giải phương trình (1) và (2)
Ta có: x = 0,5; y = 0,6
m = 0,5.56 = 28 gam
Câu 25.
Gọi công thức hóa họccủa muối sunfat của kim loại hóa II RSO4
Ta có
nBaCl2 = 0,24 mol
nFe2(SO4)3 = 8/400 = 0,02 mol
Phương trình hóa học
RSO4 + BaCl2 → BaSO4↓+ RCl2
Fe2(SO4)3 + 3BaCl2 → 3BaSO4↓+ 2FeCl3
⇒n↓= nBaSO4= 20,97/233 = 0,09 mol
Ta có:
nBaCl2 = nBaSO4 = 0,09 mol ⇒ CM(BaCl2)= 0,09:0,1 = 0,9M
nBaSO4 = nRSO4 + 3.nFe2(SO4)3⇒ nRSO4= 0,09 − 3.0,02=0,03 mol
⇒MRSO4 = 3,6: 0,03 = 120 ⇒ MR = 24 (Mg)
Đề thi Hóa học kì 2 lớp 10 - Đề số 3
(Cho Fe = 56; Na = 23; Ca = 40; Mg = 24; Mn = 55; Cu = 64; Al = 27, Zn = 65, S = 32, O = 16; Cl = 35,5; Ag = 108; H = 1)
Câu 1. Số oxi hoá của clo trong các chất: NaCl, NaClO, KClO3, Cl2, KClO4 lần lượt là:
A. –1, +1, +3, 0, +7.
B. –1, +1, +5, 0, +7.
C. –1, +3, +5, 0, +7.
D. +1, –1, +5, 0, +3.
Câu 2. Khí nào sau đây có khả năng làm mất màu nước brom?
A. N2.
B. CO2.
C. H2.
D. SO2.
Câu 3. Sục khí clo vào lượng dung dịch NaOH ở nhiệt độ thường, sản phẩm là
A. NaCl, NaClO.
B. NaCl, NaClO2.
C. NaCl, NaClO3.
D. Chỉ có NaCl.
Câu 4. Khi phản ứng thuận nghịch ở trạng thái cân bằng thì nó:
A. Không xảy ra nữa
C. Vẫn tiếp tục xảy ra
B. Chỉ xảy ra theo chiều thuận
D. Chỉ xảy ra theo chiều nghịch
Câu 5. Có 4 dung dịch NaF, NaCl, NaBr, NaI đựng trong các lọ bị mất nhãn. Nếu dùng dung dịch AgNO3 thì có thể nhận biết được
A. 1 dung dịch
B. 2 dung dịch
C. 3 dung dịch
D. 4 dung dịch
Câu 6. Hóa chất nào sau đây không được đựng bằng lọ thủy tinh?
A. HNO3.
B. HF.
C. HCl.
D. NaOH.
Câu 7. Cho sơ đồ:
Cl2 + KOH ![]() \(\overset{t^{\circ } }{\rightarrow}\) A + B + H2O
\(\overset{t^{\circ } }{\rightarrow}\) A + B + H2O
Cl2 + KOH ![]() \(\overset{t^{\circ } }{\rightarrow}\) A + C + H2O
\(\overset{t^{\circ } }{\rightarrow}\) A + C + H2O
Công thức hoá học của A, B, C, lần lượt là:
A. KCl, KClO, KClO4.
B. KClO3, KCl, KClO.
C. KCl, KClO, KClO3.
D. KClO3, KClO4, KCl.
Câu 8. Lưu huỳnh tác dụng với dung dịch kiềm nóng theo phản ứng sau:
S + KOH ![]() \(\rightarrow\) K2S + K2SO3 + H2O
\(\rightarrow\) K2S + K2SO3 + H2O
Tỉ lệ số nguyên tử lưu huỳnh bị oxi hóa và số nguyên tử lưu huỳnh bị khử là:
A. 2 : 1.
B. 1 : 2.
C. 1 : 3.
D. 2 : 3.
Câu 9. Dẫn 1,12 lít khí SO2 (đktc) vào 200ml dung dịch NaOH 1M, dung dịch được có chứa
A. NaHSO3
B. NaHSO3 và Na2SO3
C. Na2SO3 và NaOH
D. Na2SO3
Câu 10. Cho 10 gam hỗn hợp Fe, FeO, Fe2O3 tác dụng với dung dịch H2SO4 loãng dư, thấy có 3,36 lít khí thoát ra (đktc). Thành phần % khối lượng của Fe trong hỗn hợp là:
A. 84%
B. 8,4 %
C. 48%
D. 42%
Câu 11. Biết tỉ khối hơi của hỗn hợp Y gồm oxi và ozon đối với khí metan là 2,4. Phần trăm theo thể tích của mỗi khí trong hỗn hợp Y là:
A. 40%, 60%
B. 70%, 30%
C. 50%, 50%
D. 45%, 55%
Câu 12. Cho phản ứng sau: Các chất phản ứng → các chất sản phẩm. Yếu tố không ảnh hưởng đến tốc độ phản ứng nói trên là:
A. Nồng độ các chất phản ứng
B. Nồng độ các chất sản phẩm
C. Nhiệt độ
D. Chất xúc tác
Câu 13. Cho hỗn hợp gồm Fe và FeS hòa tan vào dung dịch HCl dư thu được 6,72 lít hỗn hợp khí (đktc). Dẫn toàn bộ hỗn hợp này qua dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa đen. % khối lượng Fe và FeS có trong hỗn hợp ban đầu là:
A. 25,2%; 74,8%
B. 24,14%, 78,86%
C. 32%; 68%
D. 60%; 40%
Câu 14. Thể tích khí thu được sau phản ứng khi cho 6,5 gam Zn tác dụng với axit H2SO4 đặc nóng
A. 4,48 lít
B. 2,24 lít
C. 3,36 lít
D. 1,12 lít
Câu 15. 16,5 gam hỗn hơp Mg, Fe, Zn tác dụng vừa đủ với dung dịch H2SO4 loãng thấy thoát ra 4,48 lít khí H2 (đktc). Sau phản ứng cô cạn thu được khối lượng muối khan là:
A. 34,3 gam
B. 43,3 gam
C. 35,7 gam
D. 33,8 gam
Câu 16. Có 5 lọ mất nhãn có các muối NaCl, KNO3, Pb(NO3)2, CuSO4, FeCl2. Khi sục khí H2S qua các dung dịch muối trên, có bao nhiêu trường hợp có phản ứng sinh ra kết tủa?
A. 1
B. 2
C. 4
D. 3
Câu 17. Trong gia đình, nồi áp suất được sử dụng để nấu chín kỹ thức ăn. Lí do nào sau đây là thích hợp cho việc sử dụng nồi áp suất?
A. Tăng áp suất và nhiệt độ lên thức ăn.
B. Giảm hao phí năng lượng.
C. Giảm thời gian nấu ăn.
D. Cả A, B và C đúng.
Câu 18. Hòa tan hoàn toàn 11,2 gam kim loại A có hóa trị II vào H2SO4 loãng thu được 4,48 lít H2 (đktc). Kim loại A là:
A. Mg
B. Zn
C. Cu
D. Fe
Câu 19. Khi tăng thêm 10oC, tốc độ phản ứng hóa học tăng lên 4 lần. Vậy khi giảm nhiệt độ từ 70oC xuống 40oC thì tốc độ phản ứng giảm đi
A. 32 lần
B. 64 lần
C. 128 lần
D. 16 lần
Câu 20. Sản phẩm tạo thành của phản ứng giữa Fe3O4 với H2SO4 đặc, nóng, dư là:
A. Fe2(SO4)3, SO2, H2O
B. Fe2(SO4)3, H2O
C. FeSO4, SO2, H2O
D. FeSO4, Fe2(SO4)3
Câu 21. So sánh tốc độ của 2 phản ứng sau (thực hiện ở cùng nhiệt độ, thành phần Zn như nhau):
Zn + dung dịch CuSO4 1M (1)
Zn + dung dịch CuSO4 2M (2)
Kết quả thu được là:
A. 1 nhanh hơn 2.
B. 2 nhanh hơn 1.
C. như nhau.
D. không xác định.
Câu 22. Có 2 dung dịch axit HCl có nồng độ 10% và 3%. Để thu được dung dịch axit HCl mới có nồng độ 5% thì phải trộn chúng theo tỉ lệ khối lượng là:
A. 2:2
B. 2:3
C. 2:5
D. 2:4
Câu 23. Khí HCl khô khi gặp quỳ tím thì làm quỳ tím
A. chuyển sang màu đỏ.
B. chuyển sang màu xanh.
C. không chuyển màu.
D. chuyển sang không màu.
Câu 24. Các chất trong nhóm nào sau đây đều tác dụng với dung dịch HCl?
A. Quỳ tím, SiO2, Fe(OH)3, Zn, Na2CO3.
B. Quỳ tím, CuO, Cu(OH)2, Zn, Na2CO3.
C. Quỳ tím, CaO, NaOH, Ag, CaCO3.
D. Quỳ tím, FeO, NH3, Cu, CaCO3.
Câu 25. Hòa tan toàn 13,76 gam hỗn hợp X gồm hai muối NaCl và NaBr vào nước thu được dung hoàn dịch X. Cho khí clo lội từ từ cho đến dư qua dung dịch X thu được dung dịch Y. Làm bay hơi dung dịch Y cho tới khi thu được 12,87 gam muối khan B. Khối lượng của NaCl trong hỗn hợp X là
A. 11,7 gam
B. 5,85 gam
C. 8,77 gam
D. 9,3 gam
Đáp án đề kiểm tra cuối kì 2 môn Hóa học 10 - Đề số 3
| 1B | 2D | 3A | 4B | 5D |
| 6B | 7C | 8A | 9A | 10A |
| 11A | 12B | 13B | 14A | 15C |
| 16D | 17D | 18B | 19B | 20A |
| 21B | 22C | 23C | 24B | 25A |
Đề thi Hóa học kì 2 lớp 10 - Đề số 4
(Cho Fe = 56; Na = 23; Ca = 40; Mg = 24; Mn = 55; Cu = 64; Al = 27, Zn = 65, S = 32, O = 16; Cl = 35,5; Ag = 108; H = 1)
Câu 1. Số oxi hoá của clo trong các chất: NaCl, NaClO, KClO3, Cl2, KClO4 lần lượt là:
A. –1, +1, +3, 0, +7.
B. –1, +1, +5, 0, +7.
C. –1, +3, +5, 0, +7.
D. +1, –1, +5, 0, +3.
Câu 2. Khí nào sau đây có khả năng làm mất màu nước brom?
A. N2.
B. CO2.
C. H2.
D. SO2.
Câu 3. Sục khí clo vào lượng dung dịch NaOH ở nhiệt độ thường, sản phẩm là
A. NaCl, NaClO.
B. NaCl, NaClO2.
C. NaCl, NaClO3.
D. Chỉ có NaCl.
Câu 4. Khi phản ứng thuận nghịch ở trạng thái cân bằng thì nó:
A. Không xảy ra nữa
B. Vẫn tiếp tục xảy ra
C. Chỉ xảy ra theo chiều thuận
D. Chỉ xảy ra theo chiều nghịch
Câu 5. Có 4 dung dịch NaF, NaCl, NaBr, NaI đựng trong các lọ bị mất nhãn. Nếu dùng dung dịch AgNO3 thì có thể nhận biết được
A. 1 dung dịch
B. 2 dung dịch
C. 3 dung dịch
D. 4 dung dịch
Câu 6. Hóa chất nào sau đây không được đựng bằng lọ thủy tinh?
A. HNO3.
B. HF.
C. HCl.
D. NaOH.
Câu 7. Cho sơ đồ:
Cl2 + KOH ![]() \(\overset{}{\rightarrow}\) A + B + H2O
\(\overset{}{\rightarrow}\) A + B + H2O
Cl2 + KOH ![]() \(\overset{}{\rightarrow}\) A + C + H2O
\(\overset{}{\rightarrow}\) A + C + H2O
Công thức hoá học của A, B, C, lần lượt là:
A. KCl, KClO, KClO4.
B. KClO3, KCl, KClO.
C. KCl, KClO, KClO3.
D. KClO3, KClO4, KCl.
Câu 8. Lưu huỳnh tác dụng với dung dịch kiềm nóng theo phản ứng sau:
S + KOH ![]() \(\rightarrow\) K2S + K2SO3 + H2O
\(\rightarrow\) K2S + K2SO3 + H2O
Tỉ lệ số nguyên tử lưu huỳnh bị oxi hóa và số nguyên tử lưu huỳnh bị khử là:
A. 2 : 1
B. 1 : 2
C. 1 : 3
D. 2 : 3
Câu 9. Dẫn 1,12 lít khí SO2 (đktc) vào 200ml dung dịch NaOH 1M, dung dịch được có chứa
A. NaHSO3
B. NaHSO3 và Na2SO3
C. Na2SO3 và NaOH
D. Na2SO3
Câu 10. Cho 10 gam hỗn hợp Fe, FeO, Fe2O3 tác dụng với dung dịch H2SO4 loãng dư, thấy có 3,36 lít khí thoát ra (đktc). Thành phần % khối lượng của Fe trong hỗn hợp là:
A. 84%
B. 8,4 %
C. 48%
D. 42%
Câu 11. Biết tỉ khối hơi của hỗn hợp Y gồm oxi và ozon đối với khí metan là 2,4. Phần trăm theo thể tích của mỗi khí trong hỗn hợp Y là:
A. 40%, 60%
B. 70%, 30%
C. 50%, 50%
D.45%, 55%
Câu 12. Cho phản ứng sau: Các chất phản ứng → các chất sản phẩm. Yếu tố không ảnh hưởng đến tốc độ phản ứng nói trên là:
A. Nồng độ các chất phản ứng
B. Nồng độ các chất sản phẩm
C. Nhiệt độ
D. Chất xúc tác
Câu 13. Cho hỗn hợp gồm Fe và FeS hòa tan vào dung dịch HCl dư thu được 6,72 lít hỗn hợp khí (đktc). Dẫn toàn bộ hỗn hợp này qua dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa đen. % khối lượng Fe và FeS có trong hỗn hợp ban đầu là:
A. 25,2%; 74,8%
B. 24,14%; 78,86%
C. 32%; 68%
D. 60%; 40%
Câu 14. Thể tích khí thu được sau phản ứng khi cho 6,5 gam Zn tác dụng với axit H2SO4 đặc nóng
A. 4,48 lít
B. 2,24 lít
C. 3,36 lít
D. 1,12 lít
Câu 15. 16,5 gam hỗn hơp Mg, Fe, Zn tác dụng vừa đủ với dung dịch H2SO4 loãng thấy thoát ra 4,48 lít khí H2 đktc). Sau phản ứng cô cạn thu được khối lượng muối khan là:
A. 34,3 gam
B. 43,3 gam
C. 35,7 gam
A. 33,8 gam
Câu 16. Có 5 lọ mất nhãn có các muối NaCl, KNO3, Pb(NO3)2, CuSO4, FeCl2. Khi sục khí H2S qua các dung dịch muối trên, có bao nhiêu trường hợp có phản ứng sinh ra kết tủa?
A. 1
B. 2
C. 4
D. 3
Câu 17. Trong gia đình, nồi áp suất được sử dụng để nấu chín kỹ thức ăn. Lí do nào sau đây là thích hợp cho việc sử dụng nồi áp suất?
A. Tăng áp suất và nhiệt độ lên thức ăn.
B. Giảm hao phí năng lượng.
C. Giảm thời gian nấu ăn.
D. Cả A, B và C đúng.
Câu 18. Hòa tan hoàn toàn 11,2 gam kim loại A có hóa trị II vào H2SO4 loãng thu được 4,48 lít H2 (đktc). Kim loại A là:
A. Mg
B. Zn
C. Cu
D. Fe
Câu 19. Khi tăng thêm 10oC, tốc độ phản ứng hóa học tăng lên 4 lần. Vậy khi giảm nhiệt độ từ 70oC xuống 40oC thì tốc độ phản ứng giảm đi
A. 32 lần
B. 64 lần
C. 128 lần
D. 16 lần
Câu 20. Sản phẩm tạo thành của phản ứng giữa Fe3O4 với H2SO4 đặc, nóng, dư là:
A. Fe2(SO4)3, SO2, H2O
B. Fe2(SO4)3, H2O
C. FeSO4, SO2, H2O
D. FeSO4, Fe2(SO4)3
Câu 21. So sánh tốc độ của 2 phản ứng sau (thực hiện ở cùng nhiệt độ, thành phần Zn như nhau):
Zn + dung dịch CuSO4 1M (1)
Zn + dung dịch CuSO4 2M (2)
Kết quả thu được là:
A. 1 nhanh hơn 2.
B. 2 nhanh hơn 1.
C. như nhau.
D. không xác định.
Câu 22. Có 2 dung dịch axit HCl có nồng độ 10% và 3%. Để thu được dung dịch axit HCl mới có nồng độ 5% thì phải trộn chúng theo tỉ lệ khối lượng là:
A. 2:2
B. 2:3
C. 2:5
D. 2:4
Câu 23. Khí HCl khô khi gặp quỳ tím thì làm quỳ tím
A. chuyển sang màu đỏ.
B. chuyển sang màu xanh.
C. không chuyển màu.
D. chuyển sang không màu.
Câu 24. Các chất trong nhóm nào sau đây đều tác dụng với dung dịch HCl?
A. Quỳ tím, SiO2, Fe(OH)3, Zn, Na2CO3.
B. Quỳ tím, CuO, Cu(OH)2, Zn, Na2CO3.
C. Quỳ tím, CaO, NaOH, Ag, CaCO3.
D. Quỳ tím, FeO, NH3, Cu, CaCO3.
Câu 25. Hòa tan toàn 13,76 gam hỗn hợp X gồm hai muối NaCl và NaBr vào nước thu được dung hoàn dịch X. Cho khí clo lội từ từ cho đến dư qua dung dịch X thu được dung dịch Y. Làm bay hơi dung dịch Y cho tới khi thu được 12,87 gam muối khan B. Khối lượng của NaCl trong hỗn hợp X là
A. 11,7 gam
B. 5,85 gam
C. 8,77 gam
D. 9,3 gam
Đáp án đề kiểm tra cuối kì 2 môn Hóa học lớp 10 - Đề số 4
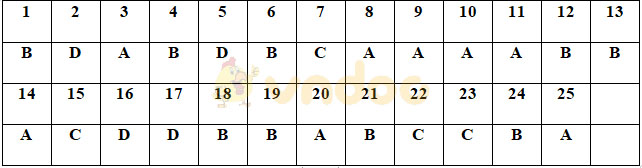
Đề thi Hóa học kì 2 lớp 10 - Đề số 5
ĐỀ SỐ 5
(Cho Fe = 56; Na = 23; Ca = 40; Mg = 24; Mn = 55; Cu = 64; Al = 27, Zn = 65, S = 32, O = 16; Cl = 35,5; Ag = 108; H = 1)
Câu 1. Hỗn hợp khí nào sau đây không tồn tại ở nhiệt độ thường?
- A. H2và F2.
- B. Cl2 và O2.
- C. H2S và N2.
- D. CO và O2.
Câu 2. Cho các phản ứng hóa học sau, phản ứng nào chứng minh Cl2 có tính oxi hoá mạnh hơn Br2 ?
- Br2+ 2NaCl → 2NaBr + Cl2
- Cl2+ 2NaOH →NaCl + NaClO + H2O
- Br2+ 2NaOH →NaBr + NaBrO + H2O
- Cl2+ 2NaBr →2NaCl + Br2
Câu 3. Chọn phát biểu sai:
- Axit clohiđric vừa có tính khử vừa có tính oxi hoá.
- Dung dịch axit clohiđric có tính axit mạnh.
- Cu hòa tan trong dung dịch axit clohiđric khi có mặt O2.
- Fe hòa tan trong dung dịch axit clohiđric tạo muối FeCl3.
Câu 4. Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 3,25 gam muối. Giá trị của m là:
|
A. 2,24 gam |
B. 2,80 gam |
C. 1,12 gam |
D. 0,56 gam |
Câu 5. Để cháy hoàn toàn hỗn hợp X gồm 3,84 gam Mg và 4,32 gam Al cần 5,824 lít hỗn hợp khí Y (đktc) gồm O2 và Cl2. Tính % thể tích Cl2 trong hỗn hợp Y?
|
A. 46,15%. |
B. 56,36%. |
C. 43,64%. |
D. 53,85%. |
Câu 6. Cho m gam hỗn hợp Zn, Fe tác dụng với vừa đủ với 73 gam dung dịch HCl 10%. Cô cạn dung dịch thu được 13,15 g muối. Giá trị m là
|
A. 7,05 gam |
B. 5,3 gam |
C. 4,3 gam |
D. 6,05 gam |
Câu 7. Cho lượng dư MnO2 vào 250 ml dung dịch HCl 1M. Thể tích khí Cl2 sinh ra (đktc) là:
|
A. 1,34 lít. |
B. 1,45 lít. |
C. 1,12 lít. |
D. 1,4 lít. |
Câu 8. Để phân biệt hai khí O2 và O3 người ta dùng dung dịch nào sau đây:
- Dung dịch KI
- Dung dịch hồ tinh bột
- Dung dịch KI có hồ tinh bột
- Dung dịch NaOH
Câu 9. Dẫn 2,24 lít khí SO2 (đktc) vào 400ml dung dịch KOH 2M, dung dịch được có chứa:
|
A. KHSO3 |
B. KHSO3 và K2SO3 |
C. K2SO3 và NaOH |
D. K2SO3 |
Câu 10. Sục một khí vào nước brom, thấy nước brom bị nhạt màu. Khí đó là:
|
A. CO2. |
B. CO. |
C. SO2. |
D. HCl. |
Câu 11. Cho 9,14 gam hỗn hợp gồm Mg, Al, Cu bằng dung dịch HCl dư thu được 7,84 lít khí (đktc), dung dịch X và 2,54 gam chất rắn Y. Khối lượng muối trong X là:
|
A. 32,15 gam |
B. 31,45 gam |
C. 33,25 gam |
D. 30,35 gam |
Câu 12. Kết luận gì có thể rút ra từ 2 phản ứng sau:
(1) SO2 + Br2 + H2O H2SO4 + HBr (2) SO2 + H2S S + H2O
- SO2 là chất khử mạnh.
- SO2 vừa có tính khử, vừa có tính oxi hóa.
- SO2 là chất oxi hóa mạnh.
- SO2 kém bền.
Câu 13. Cách pha loãng H2SO4 đặc an toàn là:
- Rót nhanh axit vào nước và khuấy đều.
- Rót nhanh nước vào axit và khuấy đều.
- Rót từ từ nước vào axit và khuấy đều.
- Rót từ từ axit vào nước và khuấy đều.
Câu 14. Thể tích khí thu được sau phản ứng khi cho 19,5 gam Zn tác dụng với axit H2SO4 loãng
|
A. 4,48 lít |
B. 6,72 lít |
C. 12,1 lít |
D. 13,44 lít |
Câu 15. Hòa tan 11,2 lít khí HCl (đktc) và m gam dung dịch HCl 16% thu được dung dịch HCl 20%, giá trị của m là:
|
A. 36,5 gam |
B. 128,5 gam |
C. 365,0 gam |
D. 224,0 gam |
Câu 16. Trong phòng thí nghiệm người ta thường điều chế HCl bằng cách
- Clo hóa các hợp chất hữu cơ
- Đun nóng hợp chất HCl đặc
- Cho clo tác dụng với Hidro
- Cho NaCl rắn tác dụng với H2SO4đặc
Câu 17. Brom có lẫn ít tạp chất clo. Một trong những chất có thể loại bỏ clo ra khỏi hỗn hợp
|
A. KBr |
B. KCl |
C. NaOH |
D. H2O |
Câu 18. Cho 174 gam hỗn hợp M2CO3 và M2SO3 (M là kim loại kiềm) vào dung dịch HCl dư. Toàn bộ khí CO2 và SO2 thoát ra hấp thụ tối thiểu bởi 500ml dung dịch NaOH 3M. Kim loại M là:
|
A. Li |
B. Na |
C. K |
D. Rb |
Câu 19. Khi tăng thêm 10oC, tốc độ phản ứng hóa học tăng lên 4 lần. Vậy khi giảm nhiệt độ 70oC xuống 40oC thì tốc độ phản ứng giảm đi
|
A. 16 lần |
B. 32 lần |
C. 64 lần |
D 81 lần |
Câu 20. Xét phản ứng sau ở nhiệt độ không đổi: 2KClO3 2KCl + 3O2. Yếu tố không A
|
A. Kích thước hạt KClO3 |
C. Chất xúc tác |
|
B. Áp suất |
D. Nhiệt độ |
Câu 21. H2SO4 có thể tác dung được với tất cả các chất nào dưới đây:
- Fe3O4, BaCl2, NaCl, Al, Cu(OH)2
- Fe(OH)2, Na2CO3, Fe, CuO, NH3
- Zn(OH)2, CaCO3, CuS, Al, Fe2O3
- CaCO3, Cu, Al(OH)3, MgO, Zn
Câu 22. Chỉ từ các chất: Fe, S, dung dịch FeSO4 và dung dịch H2SO4 có thể có bao nhiêu phương pháp điều chết khí H2S bằng 2 phản ứng?
|
A. 1 |
B. 2 |
C. 3 |
D. 4 |
Câu 23. Cho các chất FeS (1), MgO (2), Fe (3), Fe3O4 (4), Cu (5), Cr (6). Dung dịch H2SO4 đặc nguội không tác dụng với
|
A. (3), (6) |
B. (4), (6) |
C. (5), (1) |
D. (3), (5) |
Câu 24. Giá trị hằng số cân bằng Kc của phản ứng thay đổi khi
- Thay đổi nồng độ các chất
- Thay đổi áp suất
- Thay đổi nhiệt độ
- Thêm chất xúc tác
Câu 25. Muốn hòa tan hoàn toàn hỗn hợp Zn, ZnO người ta phải dùng 100,8 ml dung dịch HCl 36,5% (d=1,19g/ml) thì thu được 8,96 lít (đktc). % khối lượng Zn và ZnO trong hỗn hợp là:
|
A. 40% và 60% |
B. 61,6% và 38,4% |
C. 52,5% và 47,5% |
D. 72,15% và 27,85% |
Đáp án đề thi Hóa học kì 2 lớp 10 - Đề số 5
| 1A | 2D | 3D | 4C | 5A |
| 6D | 7D | 8D | 9A | 10C |
| 11B | 12B | 13D | 14B | 15C |
| 16D | 17A | 18B | 19C | 20B |
| 21B | 22B | 23A | 24C | 25B |
................................
Ngoài 10 đề thi Hóa học kì 2 lớp 10 năm 2021 - 2022, các em học sinh lớp 10 còn có thể tham Đề thi học kì 2 lớp 10 của các môn Toán lớp 10, môn Vật Lý lớp 10 và Tiếng Anh lớp 10 mà VnDoc.com đã sưu tầm và chọn lọc. Hy vọng với những tài liệu này, các em học sinh sẽ học tốt môn Hóa học lớp 10 hơn.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook: Tài liệu học tập lớp 10. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.




