Chuỗi phản ứng hóa học lớp 10 Chương Halogen
Các chuỗi phản ứng hóa học lớp 10
Chuỗi phản ứng hóa học lớp 10 Chương Nguyên tố nhóm VIIA (nhóm halogen)được VnDoc biên soạn là chuỗi các phản ứng hóa học 10, với tất cả các phản ứng đặc trưng nhất của chương. Giúp các bạn học sinh luyện tập với các phương trình từ đó ghi nhớ các tính chất, công thức hóa học một cách nhanh nhất.
Hoàn thành sơ đồ phản ứng
Bài 1: Viết các phương trình phản ứng xảy ra cho các sơ đồ sau:
a. HCl → Cl2 → FeCl3 → NaCl → HCl → CuCl2 → AgCl
b. KMnO4 → Cl2 → HCl → FeCl3 → AgCl→ Cl2→ Br2 → I2
c. KMnO4 → Cl2 → HCl → FeCl2 → AgCl → Ag
d. HCl → Cl2→ FeCl3 → Fe(OH)3 → Fe2(SO4)3
e. HCl → Cl2 → NaCl → HCl → CuCl2 → AgCl → Ag
f. MnO2 → Cl2 → KClO3 → KCl → HCl → Cl2 → Clorua vôi
Đáp án hướng dẫn giải bài tập
a. HCl → Cl2 → FeCl3 → NaCl → HCl → CuCl2 → AgCl
4HCl + MnO2 ![]() \(\overset{t^{o} }{\rightarrow}\) Cl2 + MnCl2 + 2H2O
\(\overset{t^{o} }{\rightarrow}\) Cl2 + MnCl2 + 2H2O
3Cl2 + 2Fe ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
\(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
3NaOH + FeCl3 → 3NaCl + Fe(OH)3
H2SO4 + NaCl → HCl + NaHSO4
CuO + 2HCl → 2H2O + CuCl2
2AgNO3 + CuCl2 → 2AgCl + Cu(NO3)2
b. KMnO4 → Cl2 → HCl → FeCl3 → AgCl→ Cl2→ Br2 → I2
(1)16HCl + 2KMnO4 → 5Cl2 + 8H2O + 2KCl
(2) H2 + Cl2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2HCl
\(\overset{t^{\circ } }{\rightarrow}\) 2HCl
(3) Fe2O3 + 6HCl → 3H2O + 2FeCl3
(4) 3AgNO3 + FeCl3 → 3AgCl + Fe(NO3)3
(5) 2AgCl → 2Ag + Cl2
(6) Cl2 + 2KBr → Br2 + 2KCl
(7) Br2 + 2HI → I2 + 2HBr
c. KMnO4 → Cl2 → HCl → FeCl2 → AgCl → Ag
2KMnO4 +16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Cl2 + H2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2HCl
\(\overset{t^{\circ } }{\rightarrow}\) 2HCl
2HCl + Fe → FeCl2 + Cl2
FeCl2 + 3AgNO3→ Fe(NO3)3 + 2AgCl + Ag
2AgCl ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Ag + Cl2
\(\overset{t^{\circ } }{\rightarrow}\) 2Ag + Cl2
d. HCl → Cl2→ FeCl3 → Fe(OH)3 → Fe2(SO4)3
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2Fe + 3Cl2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
\(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
FeCl3 + 3NaOH→Fe(OH)3 + 3NaCl
2Fe(OH)3 + 3H2SO4→ Fe2(SO4)3 + 6H2O
e. HCl → Cl2 → NaCl → HCl → CuCl2 → AgCl → Ag
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2Na + Cl2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2NaCl
\(\overset{t^{\circ } }{\rightarrow}\) 2NaCl
2NaCl + H2SO4 → Na2SO4 + 2HCl
CuO + 2HCl → CuCl2 + H2O
CuCl2 + 2AgNO3 →Cu(NO3)2 + 2AgCl
2AgCl![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Ag + Cl2
\(\overset{t^{\circ } }{\rightarrow}\) 2Ag + Cl2
f. MnO2 → Cl2 → KClO3 → KCl → HCl → Cl2 → Clorua vôi
16HCl + 2KMnO4 → 5Cl2 + 8H2O + 2KCl + 2MnCl2
3Cl2 + 6KOH → 3H2O + 5KCl + KClO3
2KClO3 → 2KCl + 3O2
H2SO4 + 2KCl → 2HCl + K2SO4
6HCl + KClO3 → 3Cl2 + 3H2O + KCl
Ca(OH)2 + Cl2 → CaOCl2 + H2O
Bài 2: Hoàn thành chuỗi phản ứng:
a. MnO2 → Cl2 → FeCl3 → Fe(OH)3 → FeCl3 → AgCl → Cl2.
b. KMnO4 → Cl2 → HCl → CuCl2 → BaCl2 → BaSO4.
c. NaCl → HCl → Cl2 → FeCl3 → NaCl → NaOH → NaCl → Cl2 → CaCl2 → AgCl → Ag.
d. NaCl → HCl → KCl → Cl2 → NaCl → H2 → HCl → Cl2 → CuCl2 → Cu(OH)2 → CuSO4 → K2SO4 → KNO3.
Đáp án hướng dẫn giải
a. MnO2 → Cl2 → FeCl3 → Fe(OH)3 → FeCl3 → AgCl → Cl2.
MnO2 + 4HClđ ![]() \(\overset{t^{\circ } }{\rightarrow}\) MnCl2 + Cl2 + 2H2O
\(\overset{t^{\circ } }{\rightarrow}\) MnCl2 + Cl2 + 2H2O
3Cl2 + 2Fe ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
\(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
FeCl3 + 3NaOH →Fe(OH)3 + 3NaCl
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
FeCl3 + 3AgNO3 → 3AgCl + Fe(NO3)3
2AgCl ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Ag + Cl2
\(\overset{t^{\circ } }{\rightarrow}\) 2Ag + Cl2
b. KMnO4 → Cl2 → HCl → CuCl2 → BaCl2 → BaSO4.
2KMnO4 + 16HCl đ ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 2MnCl2 + 5Cl2 + 8H2O
\(\overset{t^{\circ } }{\rightarrow}\) 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Cl2 + H2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2HCl
\(\overset{t^{\circ } }{\rightarrow}\) 2HCl
2HCl + CuO → CuCl2 + H2O
CuCl2 + Ba(OH)2 → Cu(OH)2 + BaCl2
BaCl2 + H2SO4 → BaSO4 + 2HCl
c. NaCl → HCl → Cl2 → FeCl3 → NaCl → NaOH → NaCl → Cl2 → CaCl2 → AgCl → Ag.
2NaCl + H2SO4đ![]() \(\overset{t^{\circ } }{\rightarrow}\) Na2SO4 + 2HCl
\(\overset{t^{\circ } }{\rightarrow}\) Na2SO4 + 2HCl
2HCl![]() \(\overset{đpdd}{\rightarrow}\) H2 + Cl2
\(\overset{đpdd}{\rightarrow}\) H2 + Cl2
3Cl2 + 2Fe![]() \(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
\(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3
2NaCl + 2H2O![]() \(\overset{đpdd, cmn}{\rightarrow}\)2NaOH + Cl2 + H2
\(\overset{đpdd, cmn}{\rightarrow}\)2NaOH + Cl2 + H2
NaOH + HCl → NaCl + H2O
Cl2 + Ca![]() \(\overset{t^{\circ } }{\rightarrow}\) CaCl2
\(\overset{t^{\circ } }{\rightarrow}\) CaCl2
CaCl2 + 2AgNO3 → 2AgCl + Ca(NO3)2
2AgCl![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Ag + Cl2
\(\overset{t^{\circ } }{\rightarrow}\) 2Ag + Cl2
d. NaCl → HCl → KCl → Cl2 → NaCl → H2 → HCl → Cl2 → CuCl2 → Cu(OH)2 → CuSO4 → K2SO4 → KNO3.
2NaCl + H2SO4 đ![]() \(\overset{t^{\circ } }{\rightarrow}\) Na2SO4 + 2HCl
\(\overset{t^{\circ } }{\rightarrow}\) Na2SO4 + 2HCl
2HCl + 2K → 2KCl + H2
2KCl → 2K + Cl2
Cl2 + 2Na ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2NaCl
\(\overset{t^{\circ } }{\rightarrow}\) 2NaCl
2NaCl + 2H2O![]() \(\overset{đpdd, cmn}{\rightarrow}\)2NaOH + Cl2 + H2
\(\overset{đpdd, cmn}{\rightarrow}\)2NaOH + Cl2 + H2
H2 + Cl2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2HCl
\(\overset{t^{\circ } }{\rightarrow}\) 2HCl
2HCl![]() \(\overset{đpdd}{\rightarrow}\)H2 + Cl2
\(\overset{đpdd}{\rightarrow}\)H2 + Cl2
Cl2 + Cu![]() \(\overset{t^{\circ } }{\rightarrow}\) CuCl2
\(\overset{t^{\circ } }{\rightarrow}\) CuCl2
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
CuSO4 + 2KOH → K2SO4 + Cu(OH)2
K2SO4 + Ba(NO3)2→ 2KNO3 + BaSO4
Bài 3: Viết các phương trình biểu diễn dãy biến hóa sau (ghi rõ điều kiện).
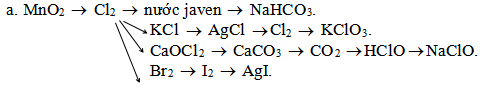
b. Cl2 → FeCl3 → NaCl → Cl2 → Br2 → HBrO → NaBrO.
c. H2 → HCl → Cl2 → FeCl2 → Fe(NO3)2 → Fe(OH)2 → FeSO4 → FeCl2 → AgNO3.
Đán án hướng dẫn giải
a.
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
Cl2 + 2NaOH → NaCl + NaClO + H2O
NaClO + CO2 + H2O → NaHCO3 + HClO
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
KCl + AgNO3 → AgCl + KNO3
4AgCl + O2 → 2Ag2O + 2Cl2
6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O
Ca(OH)2 + Cl2 → CaOCl2 + H2O
2CaOCl2 + H2O + CO2 → CaCl2 + CaCO3 + 2HClO
CaCO3 → CaO + CO2
2NaClO + CO2 + H2O → Na2CO3 + 2HClO
2HClO + NaCl → NaClO + H2O + Cl2
Cl2 + 2NaBr → Br2 + 2NaCl
Br2 + 2NaI → I2 + 2NaBr
I2 + Ag → AgI
b. Cl2 → FeCl3 → NaCl → Cl2 → Br2 → HBrO → NaBrO.
3Cl2 + 2Fe → 2FeCl3 (điều kiện: < 250 độ c)
3FeCl3 + NaOH → 3NaCl + Fe(OH)3
2H2O + 2NaCl → Cl2 + H2 + 2NaOH (điều kiện: điện phân có màng ngăn)
Cl2 + 2KBr → Br2 + 2KCl
Br2 + H2O → HBrO + HBr
HBrO + NaOH → H2O + NaBrO
c. H2 → HCl → Cl2 → FeCl2 → Fe(NO3)2 → Fe(OH)2 → FeSO4 → FeCl2 → AgNO3.
H2 + Cl2 ![]() \(\overset{as}{\rightarrow}\) 2HCl
\(\overset{as}{\rightarrow}\) 2HCl
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
4Cl2 + 2Fe2O3 → 4FeCl2 + 3O2↑
FeCl2 + 2AgNO3 → Fe(NO3)3 + 2AgCl↓
Fe(NO3)2 + 2KOH → 2KNO3 + Fe(OH)2↓
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
FeSO4 + BaCl2 → FeCl2 + BaSO4↓
Bài 4: Hãy biểu diễn sơ đồ biến đổi các chất sau bằng phương trình hoá học:
a. NaCl + H2SO4 → Khí (A) + (B)
b. (A) + MnO2 → Khí (C) + rắn (D) + (E)
c. (C) + NaBr → (F) + (G)
d. (F) + NaI → (H) + (I)
e. (G) + AgNO3→ (J) + (K)
f. (A) + NaOH → (G) + (E)
Đáp án hướng dẫn giải
A là HCl; B là Na2SO4; C là Cl2; D là MnCl2; E là H2O; F là Br2; G là NaCl; H là NaBr; I là I2; J là NaNO3; K là AgCl
Phương trình hóa học
a. 2NaCl + H2SO4 ![]() \(\overset{t^{\circ } }{\rightarrow}\) Na2SO4 + 2HCl
\(\overset{t^{\circ } }{\rightarrow}\) Na2SO4 + 2HCl
b. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
c. Cl2 + 2NaBr → Br2 + 2NaCl
d. 2NaI + Br2 → 2NaBr + I2
e. NaCl + AgNO3 →NaNO3 + AgCl
f. HCl + NaOH → NaCl + H2O
Bài 5: Xác định A, B, C, D và hoàn thành các phương trình phản ứng sau:
a. MnO2 + (A) → MnCl2 + (B)↑ + (C)
b. (B) + H2 → (A)
c. (A) + (D) → FeCl2 + H2
d. (B) + (D) → FeCl3
e. (B) + (C) → (A) + HClO
Đáp án hướng dẫn giải
a) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
b) Cl2 + H2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2HCl
\(\overset{t^{\circ } }{\rightarrow}\) 2HCl
c) 2HCl + Fe ![]() \(\overset{t^{\circ } }{\rightarrow}\) FeCl2 + H2
\(\overset{t^{\circ } }{\rightarrow}\) FeCl2 + H2
d) 3Cl2 + 2Fe ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
\(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
e) Cl2 + H2O → HCl + HClO
A là HCl; B là Cl2; C là H2O; D là Fe
Bài 6: Xác định A, B, C, D, E, F, G:
HCl + MnO2 → (A) + (B) rắn + (C) lỏng.
(A) + Fe → FeCl3.
(A) + (C) → (D) + (E)
(D) + Ca(OH)2 → (G) + (C).
(F) + (E) → (C)
(F) + (A) → (D).
Chi tiết nội dung câu hỏi bài tập nằm trong FILE TẢI VỀ
........................................................









