Tóm tắt lý thuyết Hóa 10 - Chương 2: Bảng tuần hoàn các nguyên tố hóa học - Định luật tuần hoàn
Tóm tắt lý thuyết Hóa học 10 - Chương 2: Bảng tuần hoàn các nguyên tố hóa học - Định luật tuần hoàn là tài liệu hệ thống kiến thức hóa học vô cơ lớp 10, giúp các bạn học sinh củng cố lại kiến thức về bảng tuần hoàn các nguyên tố hóa học, quan hệ giữa vị trí nguyên tố và cấu tạo nguyên tử, phương pháp giải một số bài toán chương 2, từ đó vận dụng giải các dạng bài tập tương tự... Mời các bạn cùng tham khảo.
Tóm tắt lý thuyết Hóa học 10 Chương 2
- I - BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
- II - SỰ BIẾN ĐỔI TUẦN HOÀN MỘT SỐ TÍNH CHẤT CỦA CÁC NGUYÊN TỐ
- 1. Các nguyên tố nhóm A: nguyên tố s và p
- 2. Các nguyên tố nhóm B: nguyên tố d và f. (kim loại chuyển tiếp)
- 3. Sự biến đổi một số đại lượng vật lý
- 4. Độ âm điện
- 5. Sự biến đổi tính kim loại - phi kim
- 6. Sự biến đổi hóa trị
- 7. Sự biến đổi tính axit-bazơ của oxit và hidroxit tương ứng
- 8. Định luật tuần hoàn các nguyên tố hóa học
- III. QUAN HỆ HỆ GIỮA VỊ TRÍ NGUYÊN TỐ VÀ CẤU TẠO NGUYÊN TỬ
- IV. Bài tập vận dụng
I - BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. Nguyên tắc sắp xếp
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
- Các nguyên tố có cùng số e hóa trị trong nguyên tử được xếp thành một cột.
2. Cấu tạo bảng tuần hoàn
a/ Ô nguyên tố: Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.
b/ Chu kỳ: Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần. Số thứ tự của chu kỳ trùng với số lớp electron của nguyên tử các nguyên tố trong chu kỳ đó.
- Chu kỳ nhỏ: gồm chu kỳ 1, 2, 3.
- Chu kỳ lớn: gồm chu kỳ 4, 5, 6, 7.
c/ Nhóm nguyên tố: là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
d/ Khối các nguyên tố:
- Khối các nguyên tố s: gồm các nguyên tố nhóm IA và IIA. Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
- Khối các nguyên tố p: gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He). Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
- Khối các nguyên tố d: gồm các nguyên tố thuộc nhóm B. Nguyên tố d là các nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
- Khối các nguyên tố f: gồm các nguyên tố thuộc họ Lantan và họ Actini. Nguyên tố f là các nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
II - SỰ BIẾN ĐỔI TUẦN HOÀN MỘT SỐ TÍNH CHẤT CỦA CÁC NGUYÊN TỐ
1. Các nguyên tố nhóm A: nguyên tố s và p
- Số thứ tự nhóm = số electron hóa trị = số electron lớp ngoài cùng.
- Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố.
2. Các nguyên tố nhóm B: nguyên tố d và f. (kim loại chuyển tiếp)
- Cấu hình electron nguyên tử có dạng: (n – 1)da ns2 (a = 1 → 10)
- Số electron hóa trị = số electron lớp n + số electron phân lớp (n – 1)d nhưng chưa bão hòa.
- Đặt S = a + 2, ta có: - S ≤ 8 thì S = số thứ tự nhóm.
- 8 ≤ S ≤ 10 thì nguyên tố ở nhóm VIII B.
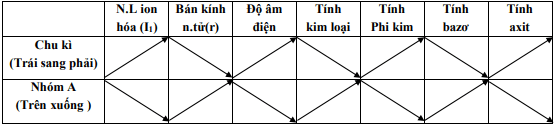
3. Sự biến đổi một số đại lượng vật lý
a/ Sự biến đổi bán kính nguyên tử khi điện tích hạt nhân tăng:
- Trong cùng chu kỳ: bán kính giảm.
- Trong cùng nhóm A: bán kính tăng.
b/ Sự biến đổi năng lượng ion hóa thứ nhất của các nguyên tố nhóm A: Khi điện tích hạt nhân tăng:
- Trong cùng chu kỳ năng lượng ion hóa tăng.
- Trong cùng nhóm, năng lượng ion hóa giảm.
Năng lượng ion hóa thứ nhất (I1) của nguyên tử là năng lượng tối thiểu cần để tách electron thứ nhất ra khỏi nguyên tử ở trạng thái cơ bản. (tính bằng Kj/mol)
4. Độ âm điện
Độ âm điện của một nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.
Khi điện tích hạt nhân tăng:
- trong cùng chu kỳ, độ âm điện tăng.
- trong cùng nhóm, độ âm điện giảm.
5. Sự biến đổi tính kim loại - phi kim
a/ Trong cùng chu kỳ, khi điện tích hạt nhân tăng:
* Tính kim loại giảm, tính phi kim tăng dần.
b/ Trong cùng nhóm A, khi điện tích hạt nhân tăng:
* Tính kim loại tăng, tính phi kim giảm dần.
6. Sự biến đổi hóa trị
Trong cùng chu kỳ, khi điện tích hạt nhân tăng, hóa trị cao nhất với oxi tăng từ 1 đến 7, hóa trị đối với hidro giảm từ 4 đến 1.
| Hóa trị đối với hidro = Số thứ tự nhóm – Hóa trị đối với oxi |
Công thức phân tử ứng với các nhóm nguyên tố (R: là nguyên tố)
R2On: n là số thứ tự của nhóm.
RH8-n: n là số thứ tự của nhóm.
| Nhóm | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| Oxit | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 |
| Hiđrua | RH4 | RH3 | RH2 | RH |
7. Sự biến đổi tính axit-bazơ của oxit và hidroxit tương ứng
a/ Trong cùng chu kỳ , khi điện tích hạt nhân tăng: tính bazơ giảm, tính axit tăng.
b/ Trong cùng nhóm A, khi điện tích hạt nhân tăng: tính bazơ tăng, tính axit giảm.
Tổng kết
8. Định luật tuần hoàn các nguyên tố hóa học
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên
III. QUAN HỆ HỆ GIỮA VỊ TRÍ NGUYÊN TỐ VÀ CẤU TẠO NGUYÊN TỬ
1. Mối quan hệ cấu hình và vị trí trong HTTH.
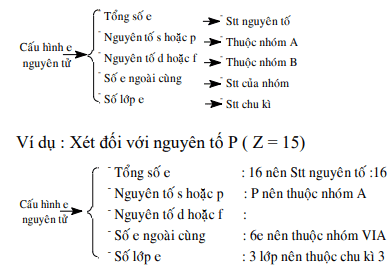
2. Quan hệ hệ giữa vị trí nguyên tố và tính chất của nguyên tố.
Vị trí nguyên tố suy ra:
Thuộc nhóm kim loại (IA, IIA, IIIA) trừ B và H.
Hoá trị trong hợp chất oxit cao nhất và trong hợp chất với hiđro.
Hợp chất oxit cao và hợp chất với hiđro.
Tính axit, tính bazơ của hợp chất oxit và hiđroxit.
Ví dụ: Cho biết S ở ô thứ 16: Suy ra:
S ở nhóm VI, CK3, PK
Hoá trị cao nhất với ôxi 6, với hiđro là 2.
CT oxit cao nhất SO3, hợp chất với hiđro là H2S.
SO3 là oxit axit và H2SO4 là axit mạnh.
3. So sánh tính chất hoá học của một nguyên tố với các nguyên tố lân cận.
a. Trong chu kì theo chiều tăng của điện tích hạt nhân, cụ thể về:
Tính kim loại yếu dần, tính phi kim mạnh dần.
Tính bazơ, của oxit và hiđroxit yếu dần, tính axit mạnh dần.
b. Trong nhóm A, theo chiều tăng của điện tích hạt nhân, cụ thể:
Tính kim loại mạnh dần, tính phi kim yếu dần.
Theo chu kỳ: Tính phi kim Si< P< S
Theo nhóm A: Tính phi kim As < P< N
4. Lưu ý khi xác định vị trí các nguyên tố nhóm B .
a. Nguyên tố họ d: (n-1)dansb với a = 1→ 10 ; b = 1 → 2
+ Nếu a + b < 8 → a + b là số thứ tự của nhóm.
+ Nếu a + b > 10 → (a + b) – 10 là số thự tự của nhóm.
+ Nếu 8 a + b 10 → nguyên tố thuộc nhóm VIII B
b. Nguyên tố họ f: (n-2)fansb với a = 1 → 14 ; b = 1 → 2
+ Nếu n = 6 → Nguyên tố thuộc họ lantan.
+ Nếu n = 7 → Nguyên tố thuộc họ actini.
(a + b) – 3 = số thứ tự của nguyên tố trong họ
Ví dụ: Z = 62 ; n = 6, a = 6, b = 2→ 6 + 2 – 3 = 5 , thuộc ô thứ 5 trong họ lantan.
IV. Bài tập vận dụng
Bài 1: Ion X2+ có cấu hình electron lớp ngoài cùng: 3d4. Xác đinh vị trí của X trong bảng hệ thống tuần hoàn.
Đáp án hướng dẫn giải
X2+ đã xuất hiện phân lớp 3d, chứng tỏ X đã xuất hiện phân lớp 4s.
X đã mất toàn bộ số e của phân lớp 4s (2e) và e của phân lớp 3d vẫn giữ nguyên (vì ion 2+ tức là X mất đi 2 e thành ion X2+)
Vậy cấu hình của X là: 1s22s22p63s23p63d54s2
→ M nằm ở ô số 25 (do Z = 25),
chu kì 4 (vì có 4 lớp e)
nhóm VIIB (vì có 7e hóa trị, e điền vào phân lớp cuối cùng là 3d).
Bài 2: R có hoá trị cao nhất với Oxi bằng hoá trị cao nhất với Hiđro. Hợp chất khí của R với Hiđro (R có hoá trị cao nhất) chứa 25% H về khối lượng. Xác định R?
Đáp án hướng dẫn giải
Đặt hóa trị của R cao nhất với Oxi là x
→ hóa trị của R cao nhất với Hidro là x
Với 1 nguyên tố ta luôn có:
Hóa trị cao nhất với oxi + hóa trị với hidro = 8 → x + x = 8 → x = 4
Vậy hóa trị của R với Hidro là 4 → công thức hợp chất với Hidro là: RH4
Theo bài, trong RH4 thì %H = 25% nên ta có:
%H = mH/mRH4.100%⇒ 4.1/MR + 4.1.100% = 25% ⇒ MR=12
MR = 12 → R là nguyên tố Cacbon.
Bài 3: Cho 6,4 g hỗn hợp hai kim loại thuộc hai chu kỳ liên tiếp, nhóm IIA tác dụng hết với dung dịch HCl dư thu được 4,48 lít khí hiđro (đktc). Xác định các kim loại?
Đap án hướng dẫn giải
Gọi kim loại trung bình là R
Phương trình hóa học:
R + 2HCl → RCl2 + H2
0,2 0,2 mol
nH2 = 0,2 mol = nR
=> MR = 6,4/0,2 = 32
Ta có: MMg = 24 < 32 < MCa = 40 => 2 kim loại cần tìm là Mg và Ca
Bài 4: Khi hoà tan hoàn toàn 3 g hỗn hợp 2 kim loại trong dung dịch HCl dư thu được 0,672 lít khí H2 (đkc). Cô cạn dung dịch sau phản ứng thu được a gam muối khan. Xác định giá trị a?
Đáp án hướng dẫn giải
Số mol của HCl
nH2= 0,672/22,4 = 0.03 mol => nHCl = 2nH2 = 0,03.2 = 0,06 mol
Ta có mmuối = mKL + mCl-= 3 + 0,06.35,5 = 5,13 gam
Bài 5: Hợp chất khí với hiđro của nguyên tố R ứng với công thức RH3. Oxit cao nhất của nguyên tố đó chứa 74,07 % O về khối lượng. Xác định R?
Đáp án hướng dẫn giải chi tiết
Hợp chất với hiđro là RH3 => Chất cao nhất với oxi có công thức là: R2O5
Ta có : 2.R/16.5 = 25,93/74,07
=> R= 14 => R là nguyên tố Nitơ
Bài 6: Hoà tan hoàn toàn 4,6 gam một kim loại kiềm trong dung dịch HCl thu được 1,321 lít khí (đktc). Xác định tên kim loại kiềm đó?
Đáp án hướng giải chi tiết
Gọi tên kim loại là R
2R +2HCl → 2RCl + H2
nH2 = V/22,4 = 1,321/22,4 = 1,321/2,24
nR = nH2×2= 1/2.1,321/2,24
M của R= m/n = 4,6: 1321/11200 = 39 (K)
Vậy kim loại kiềm là K
Bài 7: Hòa tan 4,80 gam hỗn hợp gồm 2 kim loại Mg và Fe bằng lượng vừa đủ dung dịch H2SO4 loãng. Sau phản ứng thu được 2,688 lít H2 (đktc). Khối lượng muối khan thu được là bao nhiêu?
Đáp án hướng dẫn giải chi tiết
2 kim loại đều hóa trị 2 nên có thể viết phương trình hóa học tổng quát như sau:
M + H2SO4 → MSO4 + H2
→ nSO4 = nH2 = 2,688/22,4 = 0,12 mol
mmuối = mKL + mSO4 = 4,80 + 0,12.96 = 8,16 gam
Bài 8: Cho 3,425 gam một kim loại thuộc nhóm IIA tác dụng hết với nƣớc. Sau phản ứng thu
được 560 cm3 khí hiđro (đktc). Tên và chu kì của kim loại?
Bài 9: Hoà tan 2,4gam một kim loại trong HCl có dư thu được 2,24lít H2 (đkc). Viết cấu hình
electron và xác định vị trí của kim loại trong bảng HTTH?
Bài 10: Hoà tan hoàn toàn 5,4 gam kim loại trong dung dịch H2SO4 đặc, nóng, dư thu được
6,72lít khí SO2 (đkc). Viết cấu hình electron và xác định vị trí của kim loại trong HTTH.
Bài 11: Cho 6,4g hỗn hợp hai kim loại thuộc hai chu kỳ liên tiếp, nhóm IIA tác dụng hết với
dung dịch hỗn hợp gồm HCl và H2SO4 loãng dư thu được 4,48 lít khí hiđro (đktc). Xác định các
kim loại? Viết cấu hình electron của mỗi kim loại.
.................
Để xem và tải đầy đủ chi tiết tài liệu xin vui lòng kéo xuống ấn link TẢI VỀ phía dưới.
Mời các bạn học sinh tham khảo thêm:
- Tóm tắt lý thuyết Hóa học 10 - Chương 3: Liên kết hóa học
- Tóm tắt lý thuyết Hóa học 10 - Chương 4: Phản ứng oxi hóa - khử









