Công thức tính nguyên tử khối trung bình
VnDoc xin giới thiệu bài Công thức tính nguyên tử khối trung bình được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Công thức tính nguyên tử khối trung bình
Câu hỏi: Công thức tính nguyên tử khối trung bình?
Trả lời:
Công thức tính nguyên tử khối trung bình
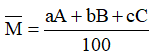
Với: a, b, c là số nguyên tử (hoặc % số nguyên tử) của mỗi đồng vị.
A, B, C là nguyên tử khối (hay số khối) của mỗi đồng vị.
I- Đồng vị
Các nguyên tử của cùng một nguyên tố hóa học có thể có số khối khác nhau. Sở dĩ như vậy vì hạt nhân của các nguyên tử đó có cùng số proton nhưng có thể khác số nơtron.
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron, do đó số khối A của chúng khác nhau.
Các đồng vị được xếp vào cùng một vị trí (ô nguyên tố) trong bảng tuần hoàn.
Thí dụ: nguyên tố hiđro có ba đồng vị
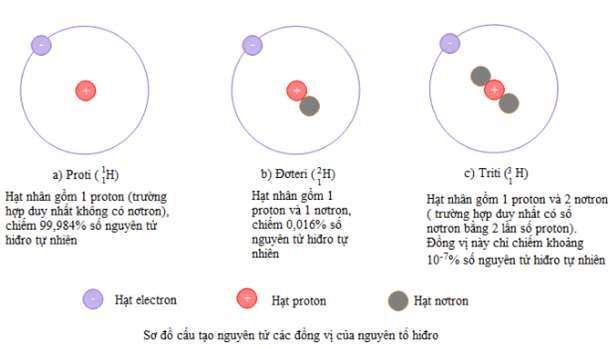
Phần lớn các nguyên tố hoá học là hỗn hợp của nhiều đồng vị. Ngoài khoảng 340 đồng vị tồn tại trong tự nhiên, người ta đã tổng hợp được 2400 đồng vị nhân tạo. Các đồng vị của cùng một nguyên tố hóa học có số nơtron trong hạt nhân khác nhau, nên có một số tính chất vật lí khác nhau.
Thí dụ: Ở trạng thái đơn chất, đồng vị 3517Cl có tỉ số khối lớn hơn, nhiệt độ nóng chảy và nhiệt độ sôi cao hơn đồng vị 3517Cl.
Người ta phân biệt các đồng vị bền và không bền. Hầu hết các đồng vị có số hiệu nguyên tử lớn hơn 83(Z>83) là không bền, chúng còn được gọi là các đồng vị phóng xạ.
Nhiều đồng vị, đặc biệt là các đồng vị phóng xạ, được sử dụng nhiều trong đời sống, y học, nghiên cứu sự phát triển của cây trồng.....
II- Nguyên tử khối và nguyên tử khối trung bình
Nguyên tử khối
Nguyên tử khối là khối lượng tương đối của nguyên tử
Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
Khối lượng của một nguyên tử bằng tổng khối lượng của proton, nơtron và electron trong nguyên tử đó. Proton và nơtron đều có khối lượng xấp xỉ 1u.
Electron có khối lượng nhỏ hơn rất nhiều (0,00055u), nên có thể coi nguyên tử khối xấp xỉ số khối của hạt nhân
Nguyên tử khối trung bình
Hầu hết các nguyên tố hóa học là hỗn hợp của nhiều đồng vị với tỉ lệ phần trăm số nguyên tử xác định, nên nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỉ lệ phần trăm số nguyên tử của mỗi đồng vị.
Giả sử nguyên tố có hai đồng vị A và B. Gọi A¯ là nguyên tử khối trung bình, A là nguyên tử khối của đồng vị A, a là tỉ lệ phần trăm số nguyên tử của đồng vị A, B là nguyên tử khối của đồng vị B, b là tỉ lệ phần trăm số nguyên tử của đồng vị B. Ta có :
Trong những tính toán không cần độ chính xác cao, người ta coi nguyên tử khối bằng số khối
III- Phương pháp và ví dụ
1/ Lý thuyết và phương pháp giải
Áp dụng công thức tính nguyên tử khối trung bình:
Với M1, M2, …, Mn: nguyên tử khối (hay số khối) của các đồng vị
x1, x2,…,xn: số nguyên tử khối hay thành phần số nguyên tử của các đồng vị
Xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Cách 2: phương pháp giải nhanh sử dụng đường chéo để làm bài
2/ Ví dụ minh họa
Ví dụ 1: Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng khác nhau về:
- số electron
- số notron
- số proton
- số obitan
Đáp án
⇒ Chọn B.
Nhắc lại: Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số notron, do đó số khối A khác nhau.
Ví dụ 2: Trong dãy kí hiệu các nguyên tử sau:
Các kí hiệu nào cùng chỉ cùng 1 nguyên tố hoá học?
- A, G và B
- H và K
- H, I và K
- E và F
Đáp án
H và K cùng 1 nguyên tố hóa học do có cùng số p là 10
⇒ Chọn B.
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Công thức tính nguyên tử khối trung bình. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.










