Có 3 đồng vị là X1 chiếm 92.23%, X2 chiếm 4,67% và X3 chiếm 3,10%.Tổng số khối của 3 đồng vị bằng 87
Có 3 đồng vị là X1 chiếm 92.23%, X2 chiếm 4,67% và X3 chiếm 3,10%.Tổng số khối của 3 đồng vị bằng 87 được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Nguyên tố hóa học
Câu hỏi: Có 3 đồng vị là X1 chiếm 92.23%, X2 chiếm 4,67% và X3 chiếm 3,10%.Tổng số khối của 3 đồng vị bằng 87. Số nơtron trong X2 nhiều hơn trong X1 một hạt. NTK TB của X là 28,0855 Hãy tìm X1, X2, X3
Trả lời:
X1 = 28; X2 = 29; X3 = 30
N1 = 14; N2 = 15; N3 = 16
Giải thích các bước giải:
- Tổng số khối: X1 + X2 + X3 = 87 (1)
- Số nơtron trong X2 nhiều hơn trong X1 một hạt: X2 − X1 = 1 (2)
- NTK trung bình:
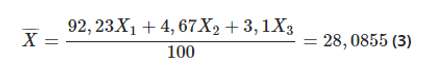
Giải hệ (1) (2) (3) được X1 = 28; X2 = 29; X3 = 30
Theo đề bài, X1 có số n bằng số p → N1 = Z (*)
Mà Z + N1 = X1 = 28 (**)
Từ (*) và (**) ⇒Z = N1=14
⇒N2 = X2 − Z = 15
N3 = X3 − Z = 16
I. Hạt nhân nguyên tử
Điện tích hạt nhân
- Proton mang điện tích 1+
=> Có Z proton thì điện tích của hạt nhân bằng Z+ và số đơn vị điện tích hạt nhân bằng Z.
- Nguyên tử trung hoà về điện nên số proton trong hạt nhân bằng số electron của nguyên tử
Số đơn vị điện tích hạt nhân Z = số proton = số electron
Ví dụ: Nguyên tử Na có: Z =13 => Nguyên tử Na có 13 proton và 13 electron.
Số khối
Số khối (kí hiệu là A) là tổng số hạt proton (kí hiệu là Z) và tổng số hạt nơtron (kí hiệu là N) của hạt nhân đó
A = Z + N
Ví dụ: Hạt nhân nguyên tử Nhôm có 13 proton và 14 notron.
⇒ Số khối A = 13 + 14 = 27
II. Nguyên tố hóa học
Định nghĩa
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân.
- Những nguyên tử có cùng điện tích hạt nhân đều có tính chất hóa học giống nhau.
Số hiệu nguyên tử
- Là số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố.
- Số hiệu nguyên tử cho biết:
+ Số proton trong hạt nhân nguyên tử
+ Số electron trong nguyên tử
+ Từ đó cũng xác định được số notron trong nguyên tử
Z = số proton = số electron = E (Nguyên tử trung hòa về điện)
N = A – Z (A là số khối, Z là số hiệu nguyên tử)
3/ Kí hiệu nguyên tử của nguyên tố X.
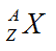
- Trong đó:
A: Số khối
Z: Số hiệu nguyên tử
X: Kí hiệu hóa học của nguyên tố
Ví dụ: 168O ⇒ nguyên tử Oxi có số khối A = 16 và số hiệu nguyên tử Z = 8
III. Đồng vị
Ví dụ 1: Oxi có 3 đồng vị:
![]()
số proton 8 8 8
số nơtron 8 9 10
Ví dụ 2: Đồng vị của nguyên tử H:
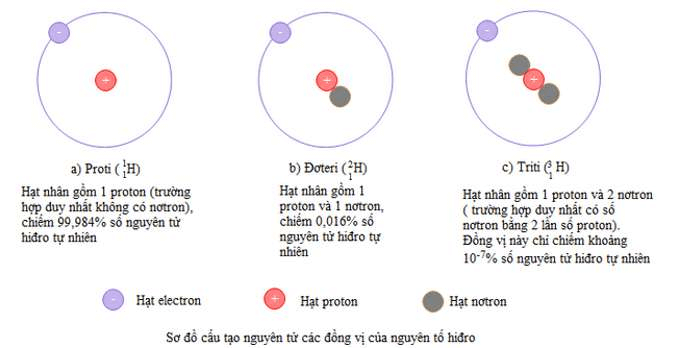
Kết luận: Các đồng vị của cùng 1 nguyên tố hoá học là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron, do đó số khối A của chúng khác nhau.
Các dạng bài tập về đồng vị.
- Xác định số phân tử chất được tạo thành từ các đồng vị.
- Tính phần trăm (%) số nguyên tử của mỗi loại đồng vị.
- Tính nguyên tử khối trung bình của các đồng vị.
- Tính số khối của đồng vị chưa biết.
- Tính % khối lượng của 1 đồng vị trong 1 hợp chất.
IV. Nguyên tử khối và nguyên tử khối trung bình của các nguyên tử hóa học
Nguyên tử khối
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
- Khối lượng của một nguyên tử bằng tổng khối lượng của proton, notron và electron trong nguyên tử đó
Nguyên tử khối trung bình
- Hầu hết các nguyên tố hóa học là hỗn hợp của nhiều đồng vị với tỉ lệ phần trăm số nguyên tử xác định => nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỉ lệ phần trăm số nguyên tử tương ứng.
- Giả sử nguyên tố X có 2 đồng vị A và B. kí hiệu A,B đồng thời là nguyên tử khối của 2 đồng vị, tỉ lệ phần trăm số nguyên tử tương ứng là a và b. Khi đó: Nguyên tử khối trung bình A của nguyên tố X là:
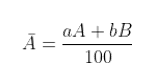
- Trong những phép toán không cần độ chính xác cao, có thể coi nguyên tử khối bằng số khối.
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Có 3 đồng vị là X1 chiếm 92.23%, X2 chiếm 4,67% và X3 chiếm 3,10%.Tổng số khối của 3 đồng vị bằng 87. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.









