Giải Hóa 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử KNTT
Giải Hóa 10 Kết nối tri thức Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Giải Hóa 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử KNTT được VnDoc biên soạn hướng dẫn bạn đọc trả lời ccác nội dung câu hỏi, thảo luận, bài tập sách giáo khoa Hóa 10 KNTT Bài 3. Hy vọng thông qua tài liệu, bạn đọc có thêm tài liệu trong quá trình học tập, soạn bài, hoàn thành các nội dung bài tập một cách tốt nhất. Mời các bạn tham khảo chi tiết nội dung dưới đây.
>> Bài trước đó: Giải Hóa 10 Bài 2: Nguyên tố Hóa học KNTT
Câu mở đầu trang 17 Hóa 10 KNTT
Trong nguyên tử các electron chuyển động như thế nào? Sự sắp xếp các electron ở các lớp, các phân lớp tuân theo nguyên lí và quy tắc nào?
Hướng dẫn trả lời câu hỏi
Trong nguyên tử, electron luôn chuyển động rất nhanh quanh hạt nhân, không theo quỹ đạo xác định và sắp xếp thành từng lớp, mỗi lớp có một số electron nhất định
- Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao (nguyên lí vững bền)
Trong cùng 1 phân lớp, các electron sẽ phân bổ trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (quy tắc Hund)
I. Chuyển động của electron trong nguyên tử
Câu 1 trang 22 SGK Hóa 10 KNTT
Mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử như thế nào?
Hướng dẫn trả lời câu hỏi
Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định. Người ta có thể xác định được vùng không gian xung quanh hạt nhân mà ở đó xác suất có mặt electron là lớn nhất (khoảng 90%).
Câu 2 trang 22 SGK Hóa 10 KNTT
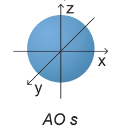
Orbital s có dạng
A. hình tròn
B. hình số tám nổi
C. hình cầu
D. hình bầu dục
Hướng dẫn trả lời câu hỏi
Đáp án C
Orbital s có dạng hình cầu
Câu 3 trang 22 SGK Hóa 10 KNTT
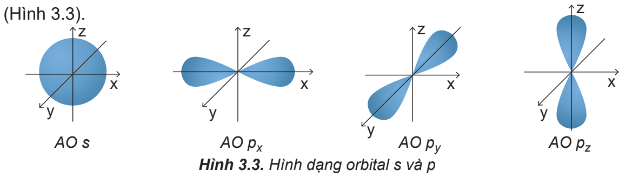
Quan sát Hình 3.3 và nêu sự định hướng của các AO p trong không gian.
Hướng dẫn trả lời câu hỏi
Orbital p gồm 3 orbital px, py, pz có dạng hình số 8 nổi.
Mỗi orbital só sự định hướng khác nhau trong không gian, chẳng hạn như:
+ Orbital px định hướng theo trục x
+ Orbital py định hướng theo trục y
+ Orbital pz định hướng theo trục z
II. Lớp và phân lớp electron
Câu 4 trang 23 SGK Hóa 10 KNTT
Hãy cho biết tổng số electron tối đa chứa trong:
a) Phân lớp p
b) Phân lớp d
Hướng dẫn trả lời câu hỏi
a) Vì phân lớp p có 3 AO px, py, pz. Trong đó mỗi AO chứa tối đa 2 electron
Tổng số electron tối đa chứa trong phân lớp p: 6
b) Vì Phân lớp d có 5 AO. Trong đó mỗi AO chứa tối đa 2 electron
=> Tổng số electron tối đa chứa trong phân lớp d: 10
Câu 5 trang 23 SGK Hóa 10 KNTT
Lớp electron có số electron tối đa gọi là lớp electron bão hòa. Tổng số electron tối đa có trong các lớp L và M là
| A. 2 và 8 | B. 8 và 10 | C. 8 và 18 | D. 18 và 32 |
Hướng dẫn trả lời câu hỏi
Đáp án C
Xét lớp thứ hai (lớp L, với n = 2)
Lớp thứ 2 (lớp L) có 2 phân lớp, được kí hiệu là 2s, 2p
Mà phân lớp s có 1 AO, phân lớp p có 3 AO. Mỗi AO chứa tối đa 2 electron
Vậy tổng số electron tối đa có trong lớp L = 1.2 + 3.2 = 8 electron
Xét lớp thứ ba (lớp M, với n = 3)
Lớp thứ 3 (lớp M) có 3 phân lớp, được kí hiệu là 3s, 3p và 3d
Mà phân lớp s có 1 AO, phân lớp p có 3 AO, phân lớp d có 5 AO. Mỗi AO chứa tối đa 2 electron
Vậy tổng số electron tối đa có trong lớp L = 1.2 + 3.2 + 5.2 = 18 electron
III. Cấu hình electron của nguyên tử
Câu 6 trang 24 SGK Hóa 10 KNTT
Cấu hình electron của nguyên tử có Z = 16 là:
| A. 1s22s22p63s23p3 | B. 1s22s22p63s23p5 |
| C. 1s22s22p63s23p4 | D. 1s22s22p63s23p6 |
Hướng dẫn trả lời câu hỏi
Đáp án C
Bước 1: Xác định số electron trong nguyên tử
Nguyên tử có Z = 16 => Có 16 electron
Bước 2:
Viết theo thứ tự các lớp và phân lớp theo thứ tự tăng của năng lượng: 1s 2s 2p 3s 3p 4s 3d…
Lưu ý: trong đó phân lớp s chứa tối ta 2 electron, phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron, phân lớp f chứa tối đa 14 electron)
Bước 3: Điền các electron vào các phân lớp theo nguyên vừng bền cho đến electron cuối cùng
Điền các electron: 1s22s22p63s23p4
>> Xem thêm lời giải: Cấu hình electron của nguyên tử có Z = 16 là:...
Câu 7 trang 24 SGK Hóa 10 KNTT
Biểu diễn cấu hình electron của các nguyên tử có Z = 8 và Z = 11 theo ô orbital.
Hướng dẫn trả lời câu hỏi
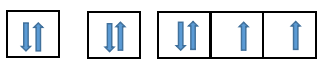
Z = 8 => Tổng số electron của nguyên tử 8
Viết theo thứ tự các lớp và phân lớp theo thứ tự tăng của năng lượng: 1s 2s 2p 3s 3p 4s 3d…
Điền các electron: 1s22s22p4
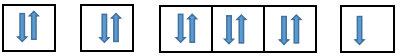
Z = 11 => Tổng số electron của nguyên tử 11
Viết theo thứ tự các lớp và phân lớp theo thứ tự tăng của năng lượng: 1s 2s 2p 3s 3p 4s 3d…
Điền các electron: 1s22s22p63s1
>> Xem thêm lời giải: Biểu diễn cấu hình electron của các nguyên tử có Z = 8 ....
Câu 8 trang 25 SGK Hóa 10 KNTT
Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn, …. Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
Hướng dẫn trả lời câu hỏi
Nguyên tử có Z = 14 => Có 14 electron
Điền các electron: 1s22s22p63s23p2

Nguyên lí vững bền: các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm orbital mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d…
Nguyên lí Pauli: trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau, nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên
Quy tắc Hund: trong cùng 1 phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa, các electron này có chiều tự quay giống nhau.
>> Xem thêm lời giải: Silicon được sử dụng trong nhiều ngành công nghiệp ....
Câu 9 trang 25 SGK Hóa 10 KNTT
Chlorine (Z= 17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Viết cấu hình electron của nguyên tử chlorine và cho biết tại sao chlorine là phi kim.
Hướng dẫn trả lời câu hỏi
Nguyên tử chlorine có Z = 17 => Có 17 electron
- Viết theo thứ tự: 1s 2s 2p 3s 3p 4s 3d… (trong đó phân lớp s chứa tối ta 2 electron, phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron, phân lớp f chứa tối đa 14 electron)
- Điền các electron: 1s22s22p63s23p5
- Nguyên tố chlorine có 7 electron lớp ngoài cùng (lớp 3)
=> Nguyên tố phi kim
>> Xem thêm tại: Chlorine (Z= 17) thường được sử dụng để khử trùng
Câu 10 trang 25 SGK Hóa 10 KNTT
Nguyên tố calcium giúp xương chắc, khỏe. Cấu hình electron lớp ngoài cùng của nguyên tử calcium là 4s2. Hãy viết cấu hình electron đầy đủ của nguyên tử calcium và cho biết nguyên tố calcium là kim loại, phi kim hay khí hiếm.
Hướng dẫn trả lời câu hỏi
Cấu hình electron của calcium là: 1s22s22p63s23p64s2
Calcium là kim loại vì có 2 electron lớp ngoài cùng.
Calcium là kim loại
>> Bài tiếp theo: Giải Hóa 10 Bài 4: Ôn tập Chương 1
IV. Trắc nghiệm Cấu trúc lớp vỏ electron nguyên tử
Để giúp bạn đọc củng cố, nâng cao kiến thức, kĩ năng giải bài tập. VnDoc đã biên soạn bộ câu hỏi bài tập dưới dạng hình thức trắc nghiệm khách quan. Bạn đọc có thể làm trực tiếp, tự đánh giá thông qua điểm số.
......................................................
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử KNTT. Ngoài ra, các em học sinh có thể tham khảo môn Lý 10 Kết nối tri thức và Toán 10 kết nối tri thức, Sinh 10 Kết nối tri thức đầy đủ khác.
Hãy tham gia ngay chuyên mục Hỏi đáp các lớp của VnDoc. Đây là nơi kết nối học tập giữa các bạn học sinh với nhau, giúp nhau cùng tiến bộ trong học tập. Các bạn học sinh có thể đặt câu hỏi tại đây:
- Truy cập ngay: Hỏi - Đáp học tập
Hỏi đáp, thảo luận và giao lưu về Toán, Văn, Hóa, Lý, Sinh, Tiếng Anh,... từ Tiểu Học đến Trung học phổ thông nhanh nhất, chính xác nhất.








