Giải Hóa 10 Bài 3: Nguyên tố hóa học Cánh diều
Giải Hóa 10 Cánh diều Bài 3: Nguyên tố hóa học
Giải Hóa 10 Bài 3: Nguyên tố hóa học Cánh diều được VnDoc biên soạn hướng dẫn bạn đọc giải chi tiết các nội dung câu hỏi sách giáo khoa cánh diều Hóa 10 bài 3 Nguyên tố hóa học. Từ đó bạn đọc có thêm tài liệu chuẩn bị, soạn bài trước khi đến lớp, cũng như củng cố các nội dung kiến thức. Mời các bạn tham khảo chi tiết nội dung dưới đây.
>> Bài trước đó: Giải Hóa 10 Bài 2: Thành phần của nguyên tử Cánh diều
Mở đầu trang 16 Hóa 10 Cánh diều
Những nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?
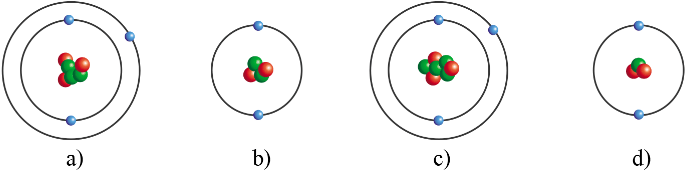
Hướng dẫn trả lời câu hỏi
Các nguyên tử mà hạt nhân có cùng số proton thuộc cùng một nguyên tố hóa học.
Nguyên tử ở hình a) và c) thuộc cùng một nguyên tố hóa học vì cùng có 3 proton (hạt màu đỏ).
Nguyên tử ở hình b) và d) thuộc cùng một nguyên tố hóa học vì cùng có 2 proton (hạt màu đỏ).
A. Trả lời câu hỏi và thảo luận
Câu 1 trang 16 SGK Hóa 10 Cánh diều
Nguyên tử lithium (Li) có 3 proton trong hạt nhân. Khi Li tác dụng với khí chlorine (Cl2) sẽ thu được muối lithium chlorine (LiCl), trong đó Li tồn tại ở dạng Li+. Ion Li+ có bao nhiêu proton trong hạt nhân?
Hướng dẫn trả lời câu hỏi
Nguyên tử Li và ion Li+ đều thuộc cùng 1 nguyên tố hóa học là Li
Li+ là nguyên tử Li sau khi mất đi 1 electron. Do vậy Li+ sẽ có 3 proton và 2 electron
=> Trong hạt nhân Li và Li+ đều có cùng số hạt proton là 3.
Câu 2 trang 17 SGK Hóa 10 Cánh diều
Một loại nguyên tử Lithium có 3 proton, 4 neutron. Viết kí hiệu nguyên tử của Lithium đó.
Hướng dẫn trả lời câu hỏi
Nguyên tử Li có 3 proton và 4 neutron
Số hiệu nguyên tử Z = số proton (p)
Số khối A = p + n
=> Số hiệu nguyên tử của Li là 3 và số khối của Li = 3 + 4 = 7
=> Kí hiệu nguyên tử của Lithium đó: ![]() \(_{3}^{7}Li\)
\(_{3}^{7}Li\)
Câu 3 trang 18 SGK Hóa 10 Cánh diều
Cho các nguyên tử sau:
![]() \(_{2}^{5}X ,\: _{3}^{7}R ,\: _{4}^{9}Z ,\: _{5}^{11}M ,\: _{5}^{12}T\)
\(_{2}^{5}X ,\: _{3}^{7}R ,\: _{4}^{9}Z ,\: _{5}^{11}M ,\: _{5}^{12}T\)
Những nguyên tử nào là đồng vị của nhau?
Hướng dẫn trả lời câu hỏi
Trong các nguyên tử: ![]() \(_{2}^{5}X ,\: _{3}^{7}R ,\: _{4}^{9}Z ,\: _{5}^{11}M ,\: _{5}^{12}T\). Chỉ có nguyên tử M và T là có số hiệu nguyên tử (số proton) bằng nhau.
\(_{2}^{5}X ,\: _{3}^{7}R ,\: _{4}^{9}Z ,\: _{5}^{11}M ,\: _{5}^{12}T\). Chỉ có nguyên tử M và T là có số hiệu nguyên tử (số proton) bằng nhau.
Vậy nguyên tử M và T là đồng vị của nhau.
Câu 4 trang 18 SGK Hóa 10 Cánh diều
Chlorine có hai đồng vị bền là 35Cl và 37Cl. Nguyên tử khối trung bình của chlorine là 35,45. Tính tỉ lệ phần trăm số nguyên tử mỗi đồng vị của chlorine trong tự nhiên.
Hướng dẫn trả lời câu hỏi
Ta có:
Gọi tỉ lệ đồng vị 35Cl trong tự nhiên là a => Tỉ lệ đồng vị 37Cl trong tự nhiên là (100 - x)
Nguyên tử khối trung bình của Cl là 35,45
=> ![]() \(\frac{ 35.a +37.(100−a)}{100} = 35,45\)
\(\frac{ 35.a +37.(100−a)}{100} = 35,45\)
=> a = 77,5
Vậy đồng vị 35Cl chiếm 77,5% trong tự nhiên, đồng vị 37Cl chiếm 22,5% trong tự nhiên
>> Tham khảo thêm đáp án tại: Chlorine có hai đồng vị bền là 35Cl và 37Cl ...
B. Trả lời câu hỏi luyện tập
Câu 1 trang 17 SGK Hóa 10 Cánh diều
Phân tử S8 có 128 electron, hỏi số hiệu nguyên tử của lưu huỳnh (S) là bao nhiêu?
Hướng dẫn trả lời câu hỏi
Phân tử S8 nghĩa là có 8 nguyên tử S
=> 1 nguyên tử S có 128 : 8 = 16 electron
- Nguyên tử trung hòa về điện có số hạt proton = số hạt electron
=> Nguyên tử S có 16 proton
Mà số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử
=> Nguyên tử S có số hiệu nguyên tử là 16
>> Thảo luận thêm tại: Phân tử S8 có 128 electron, ...
Câu 2 trang 17 SGK Hóa 10 Cánh diều
Một nguyên tử có Z hạt proton, Z hạt electron và N hạt neutron. Tính khối lượng (gần đúng, theo amu) và số khối của nguyên tử này. Nhận xét về kết quả thu được.
Hướng dẫn trả lời câu hỏi
Ta có:
+ Khối lượng nguyên tử = số proton + số neutron + số electron.
0,00055 = Z + N + 0,00055.
Z ≈ Z + N
+ Số khối nguyên tử = số proton + số neutron = Z + N
Như vật khối lượng (gần đúng, theo amu) và số khối của nguyên tử có thể coi là bằng nhau.
>> Thảo luận thêm tại: Một nguyên tử có Z hạt proton, Z hạt electron ...
Câu 3 trang 17 SGK Hóa 10 Cánh diều
Hoàn thành bảng sau:
| Nguyên tử | Số p | Số n | Kí hiệu nguyên tử |
| C | 6 | 6 | ? |
| ? | ? | ? |
Hướng dẫn trả lời câu hỏi
Nguyên tử C có 6 proton, 6 neutron
=> Số hiệu nguyên tử Z = 6,
Số khối:
A = p + n = 6 + 6 = 12
Kí hiệu nguyên tử: ![]() \(_{11}^{23}X\)
\(_{11}^{23}X\)
=> p = Z = 11,
n = A – p = 23 – 11 = 12
Bảng chi tiết
| Nguyên tử | Số p | Số n | Kí hiệu nguyên tử |
| C | 6 | 6 | |
| X | 11 | 12 |
Câu 4 trang 18 SGK Hóa 10 Cánh diều
Trong tự nhiên, argon có các đồng vị 40Ar, 38Ar, 36Ar chiếm tương ứng khoảng 99,604%; 0,063% và 0,333% số nguyên tử. Tính nguyên tử khối trung bình của Ar.
Hướng dẫn trả lời câu hỏi
Nguyên tử khối trung bình của argon là:
(40 ×99,604+ 38× 0,063 + 36× 0,333)/(99,604+ 0,063 + 0,333) ≈ 39,99
C. Giải bài tập SGK Hóa 10 Cánh diều
Bài 1 trang 20 SGK Hóa 10 Cánh diều
Hoàn thành bảng sau đây
| Kí hiệu | Số hiệu nguyên tử | Số khối | Số proton | Số electron | Số neutron |
| ? | ? | ? | ? | ? | |
| ? | ? | 39 | 19 | ? | ? |
| ? | 16 | ? | ? | ? | 20 |
Hướng dẫn giải bài tập
Chi tiết bảng
| Kí hiệu | Số hiệu nguyên tử | Số khối | Số proton | Số electron | Số neutron |
| 18 | 40 | 18 | 18 | 22 | |
| 19 | 39 | 19 | 19 | 20 | |
| 16 | 36 | 16 | 16 | 20 |
Bài 2 trang 20 SGK Hóa 10 Cánh diều
Những phát biểu nào sau đây là đúng?
(a) Những nguyên tử có cùng số electron thì thuộc cùng một nguyên tố hóa học
(b) Hai ion dương (ion một nguyên tử) có điện tích lần lượt là +2 và +3, đều có 26 proton. Vậy hai ion này thuộc cùng một nguyên tố hóa học
(c) Hai nguyên tử A và B đều có số khối là 14. Vậy hai nguyên tử này thuộc cùng một nguyên tố hóa học.
(d) Những nguyên tử có cùng số neutron thì thuộc cùng một nguyên tố hóa học.
Hướng dẫn giải bài tập
a) Đúng vì:
Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
Tất cả nguyên tử của cùng 1 nguyên tố hóa học đều có cùng số proton và cùng số electron.
b) Đúng vì:
Hai ion đều có 26 proton hay đều có số hiệu nguyên tử = 26 => Hai ion dương này đều thuộc cùng 1 nguyên tố hóa học
c) Sai vì: nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
d) Sai vì: nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
>> Thảo luận thêm đáp án: Những phát biểu nào sau đây là đúng? ...
Bài 3 trang 20 SGK Hóa 10 Cánh diều
Trong tự nhiên, đồng có hai đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính số mol mỗi loại đồng vị có trong 6,354 gam đồng
Hướng dẫn giải bài tập
Ta có: nCu = 6,354 : 63,54 = 0,1 (mol)
Gọi tỉ lệ phần trăm của đồng vị 63Cu trong tự nhiên là a
=> Tỉ lệ phần trăm của đồng vị 65Cu trong tự nhiên là 100 – a
Nguyên tử khối trung bình của Cu là 63,54
=> ![]() \(\frac{63.a + 65.(100 − a)}{100} = 63,54\)
\(\frac{63.a + 65.(100 − a)}{100} = 63,54\)
=> x = 73
=> Tỉ lệ phần trăm của đồng vị 63Cu trong tự nhiên là 73%
=> Trong 0,1 mol Cu sẽ có 0,1. 73% = 0,073 mol 63Cu
=> Trong 0,1 mol Cu sẽ có 0,1 - 0,073 = 0,022 mol 65Cu
>> Thảo luận thêm đáp án: Trong tự nhiên, đồng có hai đồng vị bền là 63Cu
Bài 4 trang 20 SGK Hóa 10 Cánh diều
Phổ khối, hay phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng để xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của neon được biểu diễn như ở Hình 3.5.
Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1).
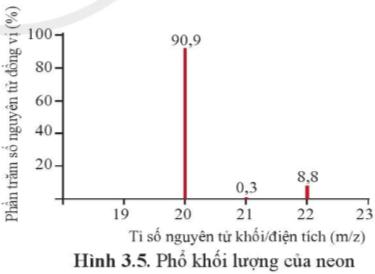
a) Neon có bao nhiêu đồng vị bền?
b) Tính nguyên tử khối trung bình của Neon.
Hướng dẫn giải bài tập
a) Neon có 3 đồng vị bền:
+ Đồng vị 20Ne chiếm 90,9%
+ Đồng vị 21Ne chiếm 0,3%
+ Đồng vị 22Ne chiếm 8,8%
b) Công thức tính nguyên tử khối trung bình:
=> ![]() \(M_{Ne} =\frac{ 90,9.20+0,3.21+8,8.22}{100} = 20,18\)
\(M_{Ne} =\frac{ 90,9.20+0,3.21+8,8.22}{100} = 20,18\)
Vậy nguyên tử khối trung bình của Neon là 20,18
>> Bài tiếp theo: Giải Hóa 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
D. Câu hỏi luyện tập
E. Trắc nghiệm Hóa học 10 Cánh diều
----------------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa 10 Bài 3: Nguyên tố hóa học Cánh diều. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Vật Lý 10 Cánh Diều và Toán 10 Tập 1 Cánh Diều, Sinh học 10 Cánh Diều đầy đủ khác.








