Orbital nguyên tử là gì? Số Orbital nguyên tử trong một phân lớp, một lớp?
Orbital nguyên tử
I. Obitan nguyên tử là gì?
Orbital nguyên tử (Atomic Orbital, viết tắt AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron là lớn nhất (khoảng 90%).
1. Hình dạng orbital nguyên tử
Khi chuyển động trong nguyên tử, các electron có những mức năng lượng khác nhau đặc trưng cho trạng thái chuyển động của nó.
Dựa trên sự khác nhau về hình dạng, sự định hướng của orbital trong nguyên tử để phân loại orbital thành orbital s, orbital p, orbital d và orbital f.
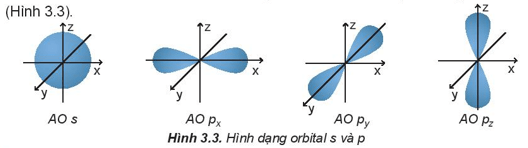
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
2. Ô orbital
Một AO được biểu diễn bằng một ô vuông, gọi là ô orbital.
Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau (nguyên lí loại trừ Pau – li).
- Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên.
- Nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước.
II. Lớp và phân lớp electron
Trong nguyên tử, các electron được sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao.
1. Lớp electron
Những electron ở lớp gần hạt nhân bị hút mạnh hơn về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở lớp xa hạt nhân.
Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau.
Người ta đánh số thứ tự lớp từ trong ra ngoài và được biểu thị bằng các số nguyên n = 1, 2, 3, …, 7 với tên gọi là các chữ cái in hoa như sau:
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Tên lớp |
K |
L |
M |
N |
O |
P |
Q |
2. Phân lớp electron
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường, theo thứ tự: s, p, d, f.
Các electron trên cùng một phân lớp có năng lượng bằng nhau.
Với 4 lớp đầu (1, 2, 3, 4) số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
- Lớp thứ nhất (lớp K, với n = 1) có một phân lớp, được kí hiệu là 1s.
- Lớp thứ hai (lớp L, với n = 2) có hai phân lớp, được kí hiệu là 2s và 2p.
- Lớp thứ ba (lớp M, với n = 3) có ba phân lớp, được kí hiệu là 3s, 3p và 3d.
- Lớp thứ tư (lớp N, với n = 4) có bốn phân lớp, được kí hiệu là 4s, 4p, 4d và 4f.
Các electron ở phân lớp s gọi là electron s, các electron ở phân lớp p được gọi là electron p….
III. Số obitan nguyên tử trong một phân lớp, một lớp
Trong một phân lớp, các orbital có cùng mức năng lượng.
- Phân lớp s: có 1 AO s
![]()
- Phân lớp p: có 3 AO px, py, pz
![]()
- Phân lớp d: có 5 AO
![]()
- Phân lớp f: có 7 AO
![]()
Trong lớp electron thứ n có n2 AO (n ≤ 4).
Ví dụ: Lớp L (n = 2) có 2 phân lớp là 2s và 2p. Trong đó, phân lớp 2s có 1AO, phân lớp 2p có 3AO nên tổng số orbital trong lớp L là 1 + 3 = 4 hay 22 AO.
--------------------------------------










