Bài tập hóa trị và số oxi hóa
Bài tập hóa trị và số oxi hóa
Chuyên đề Hóa học lớp 10: Bài tập hóa trị và số oxi hóa được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn.
I. Lý thuyết và phương pháp giải
Đối với hợp chất hữu cơ, số oxi hóa của C trong HCHO được tính là số oxi hóa trung bình; hoặc xem số oxi hóa của C là tổng đại số các số oxi hóa của các nguyên tử khác mà nó liên kết.
Chẳng hạn: Trong CH3 – CH2OH:
Số oxi hóa trung bình của C là: -2
Còn số oxi hóa của C trong CH3 là: -3 và trong CH2OH là -1.
II. Quy tắc xác định số oxi hóa
Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
Ví dụ: H2; N2; O2; Fe; Zn ....
Quy tắc 2: Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị.
Ví dụ:
| Nguyên tử | Hydrogen | Oxygen | Kim loại kiềm (IA) | Kim loại kiểm thổ (IIA) | Aluminium |
| Số oxi hoá | +1 | -2 | +1 | +2 | +3 |
Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0.
Ví dụ: ![]()
Tổng số oxi hóa = (+4) + (-2).2 = 0.
Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Ví dụ: ![]()
Tổng số oxi hóa = (-3) + (+1).4 = + 1.
Trường hợp ngoại lệ: NaH , AlH (số oxi hóa của H là -1)
Số oxi hóa của O là: -2
Ví dụ: H2O, Na2O, SO2
Trường hợp ngoại lệ:
Số oxi hóa -1: H2O2, Na2O2
Số oxi hóa +2: OF2
III. Ví dụ minh họa
Ví dụ 1. Số oxi hóa của nitơ trong NH4+, NO2- , và HNO3 lần lượt là:
A. +5, -3, +3.
B. -3, +3, +5
C. +3, -3, +5
D. +3, +5, -3.
Hướng dẫn làm bài
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitơ trong NH4+, NO2-, và HNO3
Ta có: x + 4.1 = 1 ⇒ x = -3. Số OXH của N trong NH4+ là -3
y + 2.(-2) = -1 ⇒ y = 3. Số OXH của N trong NO2- là +3
z + 1 + 3.(-2) = 0 ⇒ z = 5. Số OXH của N trong HNO3 là +5
⇒ Chọn B.
Ví dụ 2. Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3.
c) Mn, MnCl2, MnO2, KMnO4.
Hướng dẫn làm bài
a) Số oxi hóa của S trong các chất lần lượt là: S-2, S0, S+4, S+6
b) Số oxi hóa của Cl trong các hợp chất: Cl-1, Cl+1,Cl+3, Cl+5, Cl+7.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2, Mn+4, Mn+7
Ví dụ 3. Hóa trị và số oxi hóa của N trong phân tử NH4Cl lần lượt là
A. 4 và -3
B. 3 và +5
C. 5 và +5
D. 3 và -3
Hướng dẫn làm bài
N thuộc nhóm IVA nên có hóa trị 4
Số OXH: x + 4.1 + (-1)=0 ⇒ x = -3.
Ví dụ 4. Xác định số oxi hóa của các nguyên tố trong phân tử và ion sau: CO2, H2O, SO3, NH3, NO2, Na+, Cu2+ , Fe2+ , Fe3+, Al3+
Hướng dẫn làm bài
Áp dụng quy tắc xác định số oxi hóa:
+) Phân tử: ![]()
+) Ion: Số oxi hóa của Na+ , Cu2+, Fe2+ , Fe3+, Al3+ lần lượt là: +1, +2, +2, +3, +3
Ví dụ 5. Xác định số oxi hóa của Mn, Cr, Cl, P trong phân tử: KMnO4, Na2Cr2O7, KClO3, H3PO4
Hướng dẫn giải
Số oxi hóa của Mn, Cr, P: KMn+7O4, Na2Cr+62O7, KCl+5O3, H3P+5O4
Ví dụ 6. Xác định điện hóa trị của các nguyên tố trong các hợp chất sau: KCl, Na2S; Ca3N2.
Hướng dẫn làm bài
Hóa trị của một nguyên tố trong hợp chất ion gọi là điện hóa trị và bằng điện tích ion đó.
+) KCl: Điện hóa trị của K là: 1+ và của Cl là: 1-
+) Na2S: Điện hóa trị của Na là: 1+ và của S là: 2-
+) Ca3N2: Điện hóa trị của Ca là: 2+ và của N là: 3-
Ví dụ 7. Xác định số oxi hóa của cacbon trong mỗi phân tử sau:
CH3 – CH3; CH2= CH2; CH≡ CH; CH2 =CH-C≡CH;
CH3 – CH2OH; CH3 – CHO; CH3- COOH; CH3COOCH =CH2;
C6H5 – NO2; C6H5 – NH2
Hướng dẫn làm bài
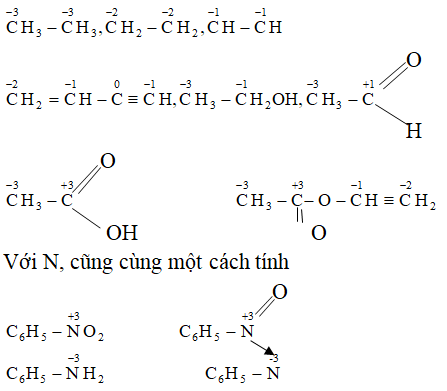
Ví dụ 8. Xác định số oxi hóa của N, S, C, Br trong ion: NO3-, SO42-; CO32-, Br, NH4+
Hướng dẫn làm bài
Số oxi hóa của N, S, C, Br: ![]()
Ví dụ 9. Xác định điện hóa trị của các nguyên tố trong các hợp chất sau: KCl, Na2S; Ca3N2.
Hướng dẫn:
Hóa trị của một nguyên tố trong hợp chất ion gọi là điện hóa trị và bằng điện tích ion đó.
+) KCl: Điện hóa trị của K là: 1+ và của Cl là: 1-
+) Na2S: Điện hóa trị của Na là: 1+ và của S là: 2-
+) Ca3N2: Điện hóa trị của Ca là: 2+ và của N là: 3-
------------------------------------








