Trắc nghiệm chương 5: Nhóm Halogen phần 7
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 5: Nhóm Halogen phần 7 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 5
Bài 1: Cần dùng 300 gam dung dịch HCl 3,65% để hòa tan vừa hết x gam Al2O3. Giá trị của x là
A. 51. B. 5,1. C. 153. D. 15,3.
Đáp án B
C% = mHCl/mdd .100% ⇒ 3,65 = mHCl/300 . 100
→ mHCl = 10,85 (g), nHCl = 0,3 (mol)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
0,05 ← 0,3 (mol)
X = 0,05.(27.2+16.3)=5,1(g)
Bài 2: Trong phản ứng:
K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O
Số phân tử HCl đóng vai trò chất khử bằng k lần tổng số phân tử HCl tham gia phản ứng. Giá trị của k là
A. 3/14. B. 4/7. C. 1/7. D. 3/7.
Đáp án D
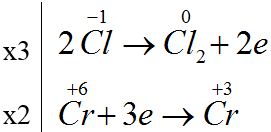
K2Cr2O7 + 14HCl → 2CrCl3 + 3Cl2 + 2KCl + 7H2O
Số phân tử HCl đóng vai trò chất khử /tổng số phân tử HCl tham gia phản ứng = 6/14=3/7
Bài 3: Phản ứng nào sau đây chứng tỏ HCl có tính khử?
A. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
B. HCl + Mg → MgCl2 + H2.
C. HCl + NaOH → NaCl + H2O.
D. 2HCl + CuO → CuCl2 + H2O.
Đáp án A.
Bài 4: Đốt 3,36 gam kim loại M trong khí quyển clo thì thu được 9,75 gam muối clorua. Kim loại M là
A. Cu. B. Zn. C. Fe. D. Al.
Đáp án C.
Gọi n là hóa trị của M.
2M + nCl2 → 2MCln
Theo pt, nM = nmuối
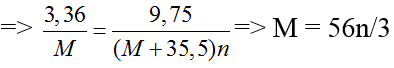
n = 1 ⇒ M = 56/3 (loại)
n = 2 ⇒ M = 112/3 (loại)
n = 3 ⇒ M = 56 (Fe)
Bài 5: Có các nhận xét sau về clo và hợp chất của clo
1. Nước Gia-ven có khả năng tẩy mầu và sát khuẩn.
2. Cho giấy quì tím vào dung dịch nước clo thì quì tím chuyển mầu hồng sau đó lại mất mầu.
3. Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
4. Trong công nghiệp, Cl2 được điều chế bằng cách điện phân dung dịch NaCl(màng ngăn, điện cực trơ).
Trong các nhận xét trên, số nhận xét đúng là
A. 2. B. 3. C. 4. D. 1
Đáp án B.
Bài 6: Để chứng minh Cl2 vừa có tính khử vừa có tính oxi hóa, người ta cho Cl2 tác dụng với
A. Dung dịch FeCl2. B. Dây sắt nóng đỏ.
C. Dung dịch NaOH loãng. D. Dung dịch KI.
Đáp án C.
Bài 7: Cho sơ đồ chuyển hoá:
![]()
(mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là:
A. NaCl, Cu(OH)2. B. HCl, NaOH.
C. Cl2, NaOH. D. HCl, Al(OH)3.
Đáp án C
2Fe + 3Cl2 → FeCl3
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl.
Bài 8: Cho các phản ứng sau:
1. A + HCl → MnCl2 + B↑ + H2O 2. B + C → nước gia-ven
3. C + HCl → D + H2O 4. D + H2O → C + B↑+ E↑
Chất Khí E là chất nào sau đây?
A. O2. B. H2. C. Cl2O. D. Cl2.
Đáp án B.
1. MnO2 + HCl → MnCl2 + Cl2 + H2O
2. Cl2 + 2NaOH → NaCl + NaClO + H2O
3. NaOH + HCl → NaCl + H2O
4. 2NaCl + 2H2O → 2NaOH + Cl2+ H2
Bài 9: Cho m gam một đơn chất halogen (X2) tác dụng hết với magie thì thu được 9,5 gam muối. Mặt khác cho m gam X2 tác dụng hết với nhôm thì thu được 8,9 gam muối. Đơn chất halogen X2 là
A. F2 B. Cl2 C. Br2 D. I
Đáp án B.
Mg + X2 → MgX2
2Al + 3X2 → 2AlX3
Bảo toàn nguyên tố X:
2nMgX2= 3nAlX3
⇒ 2.9,5/(24+2X)=3.8,9/(27+31X) ⇒ X = 35,5 (Cl)
Bài 10: Chỉ ra phát biểu sai:
A. Nước clo là dung dịch của khí clo trong nước.
B. Nước flo là dung dịch của khí flo trong nước.
C. Nước iot là dung dịch của iot trong nước.
D.Nước brom là dung dịch của brom trong nước.
Đáp án B.
Do xảy ra phản ứng: 2F2 + 2H2O → 4HF + O2
Bài 11: Bệnh fuorosis (Bệnh chết răng) gây ảnh hưởng nghiêm trọng cho dân cư Ninh Hòa là do nguyên nhân nào sau đây?
A. Nguồn thực phẩm bị nhiễm độc thuốc trừ sâu
B. Nguồn nước bị ô nhiễm flo
C. Nước thải có hợp chất chứa oxi của clo vượt quá mức cho phép.
D. Người dân không sử dụng kem đánh răng.
Đáp án B.
Bài 12: Việc ngưng sử dụng freon trong tủ lạnh và máy lạnh là do nguyên nhân nào sau đây
A. Freon phá hủy tầng ozon gây hại cho môi trường
B. Freon gây nhiễm độc nước sông, ao, hồ.
C. Freon gây độc cho người sử dụng máy lạnh, tủ lạnh.
D. Freon đắt tiền nên giá thành sản phẩm cao.
Đáp án A.
Bài 13: Ứng dụng nào sau đây không phải của Clo?
A. Khử trùng nước sinh hoạt. B. Tinh chế dầu mỏ.
C. Tẩy trắng vải, sợi, giấy. D. Sản xuất clorua vôi, kali clorat.
Đáp án B.
Bài 14: Trong tự nhiên, Clo tồn tại chủ yếu dưới dạng
A. NaCl trong nước biển và muối mỏ.
B. Khoáng vật sinvinit (KCl.NaCl).
C. Đơn chất Cl2 có trong khí thiên nhiên.
D. Khoáng vật cacnalit (KCl.MgCl2.6H2O).
Đáp án A.
Bài 15: Khối lượng thuốc tím cần dùng để điều chế 4,48 lít khí clo là (biết H = 80%)
A. 12,64 gam B. 15,8 gam C. 12,64 gam D. 15,8 gam.
Đáp án D.
nCl2 = 0,2 (mol)
16HCl +2KMnO4 → 2KCl + 2MnCl2+ 5Cl2
0,08 ← 0,2
Do H% = 80% ⇒ nKMnO4 = 0,08 . 100/80 = 0,1 mol
mKMnO4= 0,1.(39 + 55 + 16.4) = 15,8 (g)
Bài 16: Cho biết các phản ứng xảy ra sau:
(1) 2FeBr2 + Br2 → 2FeBr3
(2) 2NaBr + Cl2 → 2NaCl + Br2
Phát biểu đúng là:
A. Tính oxi hóa của Br2 mạnh hơn Cl2.
B. Tính khử của Cl- mạnh hơn của Br-.
C. Tính khử của Br- mạnh hơn Fe2+.
D. Tính oxi hóa của Cl2 mạnh hơn Fe3+.
Đáp án D.
Từ phương trình (2) : 2NaBr + Cl2 → 2NaCl + Br2 ta suy ra tính oxi hóa của Cl2 mạnh hơn Br2.
Mặt khác từ (1): FeBr2 + 1/2Br2 → FeBr3 nên tính oxi hóa của Br2 mạnh hơn Fe3+.
Bài 17: Cho sơ đồ phản ứng sau:
R + 2HCl(loãng) → RCl2 + H2.
2R + 3Cl2 → 2RCl3.
Kim loại R là
A. Zn B. Al C. Mg D. Fe
Đáp án B.
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Bài 18: Cho các phản ứng:
1. Cl2 + NaBr → NaCl + Br2
2. Cu + Cl2 → CuCl2
3. Cl2 + NaOH → NaCl + NaClO + H2O
4. Cl2 + 2FeCl2 → 2FeCl3
5. Cl2 + H2O ⇔ HCl + HClO
Số phản ứng Clo đóng vai trò làm chất oxi hóa là:
A. 5. B. 2. C. 3. D. 4.
Đáp án C
Các phương trình 1,2,4.
Bài 19: Cho các chất X; Y; Z thỏa mãn sơ đồ phản ứng sau:
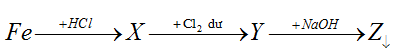
Các chất X và Z lần lượt là:
A.FeCl3, Fe(OH)3 B. FeCl2 và Fe2O3 C. FeCl2 và Fe(OH)2. D. FeCl2 và Fe(OH)3.
Đáp án D.
Fe + 2HCl → FeCl2 + H2
FeCl2 + 1/2Cl2 → FeCl3
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Bài 20: Điện phân một dd muối MCln với điện cực trơ. Khi ở catot thu được 16g kim loại M thì ở anot thu được 5,6 lít khí (đktc). Kim loại M là:
A.Mg B. Fe C.Cu D.Ca
Đáp án C.
nkhí = 0,25 (mol)
2MCln → 2M + nCl2
0,5/n ← 0,25 (mol)
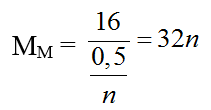
Với n = 2 ⇒ M = 64 (Cu)
Bài 21: Cho 23,7 gam KMnO4 phản ứng hết với dung dịch HCl đặc (dư), thu được V lít khí Cl2 (đktc). Giá trị của V là (H% =60%)
A. 6,72 B. 8,40 C. 5,04 D. 5,60
Đáp án C.
nKMnO4 = 23,7/158 = 0,15 mol
16HCl +2KMnO4 → 2KCl + 2MnCl2+ 5Cl2
0,15 → 0,375
Do H% = 60% ⇒ nCl2 = 0,375 . 60/100 = 0,225 mol
V = 0,225.22,4 = 5,04 (lít)
Bài 22: Cho sơ đồ chuyển hóa sau:
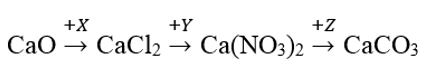
Công thức của X, Y, Z lần lượt là
A. Cl2, AgNO3, MgCO3 B. Cl2, HNO3, CO2
C. HCl, HNO3, NaNO3 D. HCl, AgNO3, (NH4)2CO3
Đáp án D.
CaO + 2HCl → CaCl2 + H2O
CaCl2 + 2AgNO3 → 2AgCl + Ca(NO3)2
Ca(NO3)2 + Na2CO3 → CaCO3 + 2NaNO3
Bài 23: Khối lượng CaF2 cần dung để điều chế 400 gam dung dịch axit flohidric nồng độ 40% (hiệu suất phản ứng bằng 80%) là
A. 624 gam B. 312 gam C. 780 gam D. 390 gam
Đáp án D.
C%HF = mHF/400 .100 = 40%
⇒ mHF =160 (g) ⇒ nHF = 8 (mol)
CaF2 + H2SO4 → CaSO4 + 2HF
4 ← 8 (mol)
Do H% = 60% ⇒ nCaF2 = 4. 100/80 = 5 mol
m = 5. (40+19.2) = 390 (g)
Bài 24: Điện phân hòa toàn 2,22 gam muối clorua kim loại ở trạng thái nóng chảy thu được 448 ml khí (ở đktc) ở anot. Kim loại trong muối là:
A.Na B.Ca C.K D.Mg
Đáp án B.
nkhí = 0,02 (mol)
2MCln → 2M + nCl2
0,04/n ← 0,02 (mol)
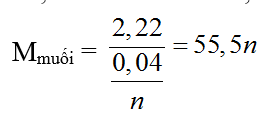
Với n = 2 ⇒ M = 40 (Ca)
Bài 25: Cho 8,7 gam MnO2 tác dụng với dung dịch axit HCl đậm đặc sinh ra V lít khí Cl2 (đktc). Hiệu suất phản ứng là 85%. V có giá trị là:
A. 2 lít. B. 2,905 lít. C. 1,904 lít. D. 1,82 lít.
Đáp án C.
nMnO2 = 0,1 mol
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
0,1 → 0,1 (mol)
Do H% = 85%⇒ nCl2 = 0,1 . 85/100 = 0,085 mol
V = 0,085.22,4 = 1,904 (lít)
Bài 26: Cho dung dịch chứa 12,06 gam hỗn hợp gồm NaF và NaCl tác dụng với dung dịch AgNO3. Thu được 17,22 gam kết tủa. Thành phần phần trăm khối lượng của NaF trong hỗn hợp ban đầu là?
A. 47,2% B. 52,8% C. 58,2% D. 41,8%
Đáp án D.
Kết tủa là AgCl.
AgNO3 + NaCl → AgCl + NaNO3
⇒ nNaCl = nAgCl = 17,22/143,5 = 0,12 (mol)
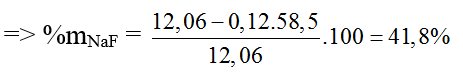
Bài 27: Cho 37,6 gam hỗn hợp gồm CaO, CuO và Fe2O3 tác dụng vừa đủ với 0,6 lít dung dịch HCl 2M, rồi cô cạn dung dịch sau phản ứng thì số gam muối khan thu được là
A. 70,6. B. 61,0. C. 80,2. D. 49,3.
Đáp án B.
nHCl = 1,2 (mol)
Oxit + 2HCl → Muối + H2O
1,2 → 0,6 (mol)
Bảo toàn khối lượng: moxit + m HCl = m muối + m nước
37,6 + 1,2.36,5 = m muối + 0,6.18
mmuối = 70,6 (g)
Bài 28: Hoà tan hỗn hợp gồm 0,2 mol Fe và 0,2 mol Fe3O4 bằng dung dịch HCl dư thu được dung dịch A. Cho A tác dụng với dung dịch NaOH dư, rồi lấy kết tủa nung trong không khí đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là :
A. 74,2. B. 42,2. C. 64,0. D. 128,0.
Đáp án C.
Ta có:
Fe + 2HCl → FeCl2 + H2
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
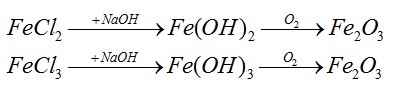
Bảo toàn Fe: nFe bđ = 0,2 + 0,2.3 = 0,8
2Fe → Fe2O3
0,8 → 0,4
⇒ m = 0,4.160 = 64 (g)
Bài 29: Cho 10,3 gam hỗn hợp Cu, Al, Fe vào dung dịch HCl thu được 5,6 lít khí (đktc) và 2 gam chất rắn không tan. Vậy % theo khối lượng của từng chất trong hỗn hợp ban đầu lần lượt là:
A. 26%, 54%, 20%. B. 20%, 55%, 25%.
C. 19,4%, 50%, 30,6%. D. 19,4%, 26,2%, 54,4%.
Đáp án D.
Chất rắn Y là Cu không phản ứng.
nH2 = 5,6 /22,4 = 0,25 mol
2Al + 6HCl → 2AlCl3 + 3H2
a 1,5a (mol)
Fe + 2HCl → FeCl2 + H2
b b (mol)
a có: 27a + 56b = 8,3
1,5a + b = 0,25 ⇒ a = b = 0,1 (mol)
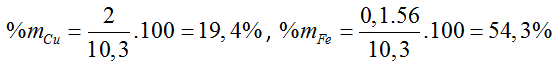
Bài 30: Hòa tan 9,6 gam một kim loại M thuộc nhóm IIA trong dung dịch HCl (dư). Cô cạn dung dịch, thu được 38 gam muối. Kim loại X là
A. canxi B. bari C. magie D. beri
Đáp án C
M + 2HCl → MCl2 + H2 ↑
M M + 71
9,6 38
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 5: Nhóm Halogen phần 7. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








