Công thức tính nguyên tử khối trung bình
Chuyên đề Hóa học lớp 10: Tính phần trăm đồng vị, tính nguyên tử khối trung bình được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Công thức nguyên tử khối trung bình
A. PHƯƠNG PHÁP GIẢI BÀI TẬP
Lý thuyết và phương pháp giải
Với M1, M2, …, Mn: nguyên tử khối (hay số khối) của các đồng vị
x1, x2,…,xn: số nguyên tử khối hay thành phần số nguyên tử của các đồng vị
Công thức tính nguyên tử khối trung bình
![]() \(\overline{M} =\frac{x_{1}.M_{1} +x_{2}.M_{2}+x_{3}.M_{3}+...x_{n}.M_{n}}{100}\)
\(\overline{M} =\frac{x_{1}.M_{1} +x_{2}.M_{2}+x_{3}.M_{3}+...x_{n}.M_{n}}{100}\)
Xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Cách 2: phương pháp giải nhanh sử dụng đường chéo để làm bài
Ví dụ: Trong tự nhiên, nguyên tố copper (Cu) có hai đồng vị là ![]() \(_{29}^{63}Cu\: và\:_{29}^{65}Cu\). Nguyên tử khối trung bình của Copper (Cu) là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị
\(_{29}^{63}Cu\: và\:_{29}^{65}Cu\). Nguyên tử khối trung bình của Copper (Cu) là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị ![]() \(_{29}^{63}Cu\) là bao nhiêu?
\(_{29}^{63}Cu\) là bao nhiêu?
Hướng dẫn

B. BÀI TẬP VÍ DỤ MINH HỌA
Ví dụ 1: Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng khác nhau về:
A. số electron
B. số notron
C. số proton
D. số obitan
Đáp án hướng dẫn giải chi tiết
⇒ Chọn B.
Nhắc lại: Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số notron, do đó số khối A khác nhau.
Ví dụ 2: Trong dãy kí hiệu các nguyên tử sau:
![]() \(_{7}^{14}A ,\: _{9}^{19}B,\: _{26}^{56}E,\: _{27}^{56}F,\: _{8}^{17}G,\: _{10}^{20}H,\: _{11}^{23}I,\: _{10}^{22}K\)
\(_{7}^{14}A ,\: _{9}^{19}B,\: _{26}^{56}E,\: _{27}^{56}F,\: _{8}^{17}G,\: _{10}^{20}H,\: _{11}^{23}I,\: _{10}^{22}K\)
Các kí hiệu nào cùng chỉ cùng 1 nguyên tố hoá học?
A. A, G và B B. H và K C. H, I và K D. E và F
Đáp án hướng dẫn giải chi tiết
H và K cùng 1 nguyên tố hóa học do có cùng số p là 10
⇒ Chọn B.
Ví dụ 3: Nguyên tố Cacbon có 2 đồng vị bền: 612C chiếm 98,89% và 613C chiếm 1,11%. Nguyên tử khối trung bình của C là bao nhiêu?
Đáp án hướng dẫn giải chi tiết
![]() \(\overline{M} =\frac{12.98,89+13.1,11}{100} =12,0111\)
\(\overline{M} =\frac{12.98,89+13.1,11}{100} =12,0111\)
Vậy NTK trung bình của C là 12,0111
Ví dụ 4: Đồng có 2 đồng vị là 2963Cu và 2965Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm số nguyên tử của mỗi đồng vị.
Đáp án hướng dẫn giải chi tiết
Đặt thành phần phần trăm của 2963Cu và 2965Cu lần lượt là x và 1-x (%)
M− = 63.x +65.(1-x) = 63.54
Giải PT ⇒ x= 0,73 (73%)
% 2963Cu = 73%; và % 2965Cu = 27%
Ví dụ 5: Trong tự nhiên, X có hai đồng vị 1735X và 1737X, chiếm lần lượt 75,77% và 24,23% số nguyên tử X. Y có hai đồng vị à 11Y và 12Y, chiếm lần lượt 99,2% và 0,8% số nguyên tử Y.
a) Trong tự nhiên có bao nhiêu loại phân tử XY?
A. 2 B. 4 C. 5 D. 6
b) Phân tử khối trung bình của XY là
A. 36,0. B. 36,5. C. 37,5. D. 37,0.
Đáp án hướng dẫn giải chi tiết
a) Các loại phân tử XY là : 35X – 1Y, 35X – 2Y, 37X – 1Y, 37X – 2Y
b) Nguyên tử khối trung bình của X :
![]() \(\frac{35.75,77+37.24,23}{100} =35,485\)
\(\frac{35.75,77+37.24,23}{100} =35,485\)
Nguyên tử khối trung bình Y là:
![]() \(\frac{1.92,2+2.0,8}{100} =1,008\)
\(\frac{1.92,2+2.0,8}{100} =1,008\)
Phân tử khối trung bình của XY: 35,485 + 1,008 =36,493 ≈ 36,5.
Ví dụ 6. Cho hợp chất AB2 tạo bởi hai nguyên tố A, B. B có hai đồng vị 79B: chiếm 55% số nguyên tử B và đồng vị 81B. Trong AB2, phần trăm khối lượng của A là bằng 28,51%. Tính nguyên tử khối trung bình của A, B.
Đáp án hướng dẫn giải chi tiết
Giải thích các bước giải:
Phần trăm số nguyên tử của 81B = 100%−55% = 45%
Suy ra, nguyên tử khối trung bình của B là :
MB = 79.55% + 81.45% = 79,9
Ta có
% A= (A/A + 2B).100% = (A/B + 79,9.2).100% = 28,51%
⇒ A = 63,73
Ví dụ 7. Carbon có hai đồng vị bền là 126C và 136C, và Số khối của carbon = 12,01. Tính % khối lượng của trong hợp chất CO2 (cho MNa = 23; MO = 16)
Đáp án hướng dẫn giải chi tiết
Gọi a, b lần lượt là % số nguyên tử của đvị 12C và 13C
Ta có hệ phương trình sau
a + b = 100 (1)
12a/100 + 13b/100 = 12,01 (2)
Giải hệ phương trình ta được a = 99, b = 1
Xét 1 mol CO2 1 mol C => mC = 12,01
2 mol O => mO = 32
Ta biết % số nguyên tử = % số mol nên
Số mol của 12C là: 0,99.1 = 0,99 mol
%m12C = (0,99.12.100)/(12,01+ 32) = 27
C. CÂU HỎI VẬN DỤNG
1. Câu hỏi trắc nghiệm khách quan
Câu 1. Nguyên tố hóa học bao gồm các nguyên tử:
A. Có cùng số khối A.
B. Có cùng số proton.
C. Có cùng số neutron.
D. Có cùng số proton và số neutron.
Đáp án B
Nguyên tố hóa học bao gồm các nguyên tử có cùng số proton khắc số notron ( hay khác số khối)
Câu 2. Trong dãy kí hiệu các nguyên tử sau, dãy nào chỉ cùng một nguyên tố hóa học:
A. 6A14 ; 7B15
B. 8C16; 8D17; 8E18
C. 26G56; 27F56
D. 10H20 ; 11I22
Câu 3. Cho ba nguyên tử có kí hiệu là 2412Mg, 2512Mg, 2612Mg. Phát biểu nào sau đây là sai ?
A. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14.
B. Đây là 3 đồng vị.
C. Ba nguyên tử trên đều thuộc nguyên tố Mg.
D. Hạt nhân của mỗi nguyên tử đều có 12 proton.
Kí hiệu của nguyên tử có dạng với Z là số hiệu nguyên tử, A là số khối
Nhận thấy 3 nguyên tử đều có cùng số Z, khác số khối → 3 nguyên tử là đồng vị của nguyên tố Mg → B, C đúng
Luôn có Z = số p = số e = 12
Câu 4. Nguyên tố chlorine có hai đồng vị bền 1735Cl chiếm 75,77% và 1737Cl chiếm 24,23%. Tính nguyên tử khối trung của chlorine?
A. 35
B. 35,5
C. 36
D. 37
Nguyên tử khối trung bình của clo là
![]() \(\overline{A_{Cl} } =\frac{35.77,75+37.24,23}{100} =35,5\)
\(\overline{A_{Cl} } =\frac{35.77,75+37.24,23}{100} =35,5\)
Câu 5. Có 3 nguyên tử: 126X, 147Y, 146Z. Những nguyên tử nào là đồng vị của một nguyên tố?
A. X, Y
B. Y, Z
C. X, Z
D. X, Y, Z
Đồng vị là những nguyên tử có cùng số proton ( số hiệu nguyên tử) khác nhau số khối
Thấy X, Z có cùng số proton là 6 , khác nhau số khối → X và Z là đồng vị của nguyên tố Cacbon.
Câu 6. Nguyên tử khối trung bình của đồng là 63,54. Trong tự nhiên, đồng có hai đồng vị 6329Cu và 6529Cu Tính tỉ lệ phần trăm số nguyên tử của đồng vị 2963Cu tồn tại trong tự nhiên
A. 28%
B. 73%
C 42%
D. 37%
Gọi x là % số nguyên tử của 2963Cu ⇒ 100 – x là % của 2965Cu
Ta có 63,54 = (63x + 65)(100 - x))/100 ⇒ x = 73
Vậy 2963Cu chiếm 73%
Câu 7. Trong tự nhiên có hai đồng vị bền: 1737Cl chiếm 24,23% tổng số nguyên tử, còn lại là 1735Cl. Thành phần % theo khối lượng của 1737Cl trong HClO4 là:
A. 8,92%
B. 8,43%
C. 8,56%
D. 8,79%
Ta có %3717Cl =24,23% => %3517Cl = 75,77%
![]() \(\overline{A_{Cl} } =\frac{35.75,77+37.24,23}{100} =35,4846\)
\(\overline{A_{Cl} } =\frac{35.75,77+37.24,23}{100} =35,4846\)
=> % về khối lượng của 3717Cl trong HClO4
![]() \({HClO_{4} } =\frac{37.24,23}{1+35,4846+16,4}.100\) = 8,92%
\({HClO_{4} } =\frac{37.24,23}{1+35,4846+16,4}.100\) = 8,92%
Câu 8. Nguyên tố carbon có hai đồng vị bền: 12C chiếm 98,89% và 13C chiếm 1,11%. Nguyên tử khối trung bình của nguyên tố carbon là
A. 12,5245
B. 12,0111
C. 12,0219
D. 12,0525
Mtb = 98.89% x 12 + 1.11% x 13 = 12,0111
Câu 9. Trong tự nhiên Oxi có 3 đồng vị 16O(x1%), 17O(x2%), 18O (4%), nguyên tử khối trung bình của Oxi là 16,14. Phần trăm đồng vị 16O và 17O lần lượt là
A. 35% và 61%
B. 90% và 6%
C. 80% và 16%
D. 25% và 71%
Luôn có x1 + x2 + 4 = 100
Nguyên tử khối trung bình của O là 16.14 = (16x1 + 17x2 + 18.4)/100
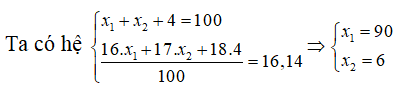
Câu 10. Một nguyên tố X gồm hai đồng vị là X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % các đồng vị trong X bằng nhau và các loại hạt trong X1 cũng bằng nhau. Xác định nguyên tử khối trung bình của X?
A. 13
B. 19
C. 12
D. 16
Các hạt trong đồng vị X1 bằng nhau nên: P = E = N = 18/3 = 6
⇒ Số khối của đồng vị X1 là: P + N= 12
⇒ Số khối của đồng vị X2 là: 20 – 6 = 14
![]() \(\overline{M } =\frac{12.50+14.50}{2} =13\)
\(\overline{M } =\frac{12.50+14.50}{2} =13\)
2. Tự luận
👉 Tải ngay file bài tập Cấu tạo nguyên tử Hóa 10!
.................................
Mời các bạn tham khảo tài liệu liên quan
- Tóm tắt lý thuyết Hóa học 10 - Chương 1: Nguyên tử
- Bài tập Hóa học lớp 10: Nguyên tử
- Tóm tắt lý thuyết Hóa học 10 - Chương 2: Bảng tuần hoàn các nguyên tố hóa học - Định luật tuần hoàn








