Sự hình thành liên kết ion
Chuyên đề Hóa học lớp 10: Sự hình thành liên kết ion được VnDoc biên soạn tổng hợp tới các bạn học sinh cùng quý thầy cô tham khảo.
Bài tập Sự hình thành liên kết ion
>> Mời các bạn tham khảo thêm câu hỏi liên quan:
- Chất nào sau đây có liên kết cộng hóa trị không cực
- Liên kết cộng hóa trị không phân cực thường là liên kết giữa
- Trong phân tử nitơ các nguyên tử liên kết với nhau bằng liên kết
- Liên kết cộng hóa trị tồn tại do
A. Phương pháp và ví dụ minh họa
Nguyên tử nhường electron tạo thành cation hoặc nhận electron tạo thành anion.
+ Khi cho electron, nguyên tử trở thành ion dương (cathode)
Ví dụ:
Thí dụ: Xét phân tử NaCl
+ Nguyên tử Na nhường 1e cho nguyên tử Cl để trở thành ion dương Na+.
Na ⟶ Na+ + 1e
+ Nguyên tử Cl nhận 1e từ Na để trở thành ion âm Cl−.
Cl + 1e ⟶ Cl−
+ Quá trình được biểu diễn như sau:
![]()
+ Hai ion tạo thành Na+ và Cl− mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử NaCl:
Na+ + Cl− ⟶ NaCl
+ Phản ứng hóa học trên có thể biểu diễn bằng phương trình hóa học sau:
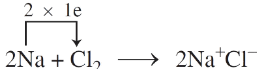
Kết luận:
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Cần nhớ điều kiện và dấu hiệu nhận biết phân tử có liên kết ion.
Điều kiện hình thành liên kết ion:
+ Liên kết được hình thành giữa các nguyên tố có tính chất khác hẳn nhau (kim loại điển hình và phi kim điển hình).
+ Quy ước hiệu độ âm điện giữa hai nguyên tử liên kết ≥ 1,7 là liên kết ion (trừ một số trường hợp).
Dấu hiệu cho thấy phân tử có liên kết ion:
+ Phân tử hợp chất được hình thành từ kim loại điển hình (kim loại nhóm IA, IIA) và phi kim điển hình (phi kim nhóm VIIA và Oxi).
2. Ví dụ minh họa
Ví dụ 1: Viết cấu hình electron của Cl (Z = 17) và Ca (Z = 20). Cho biết vị trí của chúng (chu kì, nhóm) trong bảng tuần hoàn. Liên kết giữa Calcium và chlorine trong hợp chất CaCl2 thuộc loại liên kết gì? Vì sao? Viết sơ đồ hình thành liên kết đó.
Đáp án hướng dẫn giải chi tiết
Cl (Z = 17) : 1s22s22p63s23p5
Ca (Z = 20) : 1s22s22p63s23p64s2
Clo nằm ở ô số 17, chu kỳ 3, nhóm VIIA.
Canxi nằm ở ô số 20, chu kỳ 4, nhóm IIA.
Liên kết trong hợp chất CaCl2 là liên kết ion vì Ca là kim loại điển hình, Cl là phi kim điển hình.
Sơ đồ hình thành liên kết:
2Cl + 21e → 2Cl-
Ca → Ca2+ + 2e
Các ion Ca2+ và Cl-tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất CaCl2:
Ca2+ + 2Cl- → CaCl2
Ví dụ 2: Hai nguyên tố M và X tạo thành hợp chất có công thức là M2X. Cho biết:
Tổng số proton trong hợp chất bằng 46.
Trong hạt nhân của M có n - p = 1, trong hạt nhân của X có n’ = p’.
Trong hợp chất M2X, nguyên tố X chiếm khối lượng.
1. Tìm số hạt proton trong nguyên tử M và X.
2. Dựa vào bảng tuần hoàn hãy cho biết tên các nguyên tố M, X.
3. Liên kết trong hợp chất M2X là liên kết gì? Tại sao? Viết sơ đồ hình thành liên kết trong hợp chất đó.
Đáp án hướng dẫn giải chi tiết
1. Tổng số proton trong hợp chất M2X bằng 46 nên : 2p + p’ = 46. (1)
Trong hợp chất M2X, nguyên tố X chiếm khối lượng nên:
39p’ = 8(2p + 1). (2)
Từ (1), (2) ta tìm được: p = 19; p’ = 8.
2. M là kali (K) và X là oxygen (O).
3. Liên kết trong hợp chất K2O là liên kết ion vì K là kim loại điển hình, O là phi kim điển hình.
Sơ đồ hình thành liên kết:
O + 2e → O2-
2K → 2K+ + 2.1e
Các ion K+và O2-tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất K2O:
2K+ + O2- → K2O
Ví dụ 3: a) Viết cấu hình electron của các nguyên tử A, B biết rằng:
Tổng số các loại hạt cơ bản trong nguyên tử A là 34. Số hạt mang điện nhiều hơn số hạt không mang điện là 10.
Kí hiệu của nguyên tử B là B.
b) Liên kết trong hợp chất tạo thành từ A và B thuộc loại liên kết gì? Vì sao? Viết công thức của hợp chất tạo thành .
Đáp án hướng dẫn giải chi tiết
a) Gọi tổng số hạt proton, nơtron, electron của nguyên tử A là P, N, E (trong đó P = E).
Ta có: P + N + E = 34 và P + E - N = 10.
Từ đây tìm được P = E = 11; N = 12.
Kí hiệu của nguyên tử B là B nên ZB = 9
Cấu hình electron của A, B:
A (Z = 11) : 1s22s22p63s1
B (Z = 9) : 1s22s22p5
b) Liên kết trong hợp chất giữa A và B là liên kết ion vì A là kim loại điển hình (nhóm IA), B là phi kim điển hình (nhóm VIIA).
Sơ đồ hình thành liên kết:
A → A+ + 1e
B + 1e → B-
Các ion A+và B- tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất AB:
A+ + B- → AB.
Ví dụ 4.
B. Bài tập trắc nghiệm
Câu 1. Xét các phân tử ion: LiCl, KCl, RbCl, CsCl. Liên kết trong phân tử nào mang tính chất ion nhiều nhất?
A. LiCl
B. KCl
C. RbCl
D. CsCl
Xét theo chiều tăng dần tính kim loại cũng là chiều giảm dần của độ âm điện ta có dãy Li < Na < K < Rb < Cs.Trong phân tử độ chênh lệch độ âm điện càng lớn thì tính chất ion càng lớn.
Câu 2. Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có liên kết ion?
A. H2S, NH3.
B. BeCl2, BeS.
C. MgO, Al2O3.
D. MgCl2, AlCl3.
Dựa trên tính toán độ âm điện của các hợp chất. Ý A:H2S, ý B: BeCl2, ý D có AlCl3 là các chất có liên kết cộng hóa trị.
Câu 3. Nguyên tử Al có 3 electron hóa trị. Kiểu liên kết hóa học nào được hình thành khi nó liên kết với 3 nguyên tử fluorine:
A. Liên kết kim loại.
B. Liên kết cộng hóa trị có cực.
C. Liên kết cộng hóa trị không cực.
D. Liên kết ion.
Hiệu độ âm điện của F với Al là 3,98 – 1,16 = 2,37 > 1,7.
Vậy liên kết hóa học hình thành khi Al liên kết với 3 nguyên tử fluorine là liên kết ion.
Câu 4. Cho các hợp chất: NH3, H2O, K2S, MgCl2, Na2O, CH4, Chất có liên kết ion là:
A. NH3, H2O, K2S, MgCl2
B. K2S, MgCl2, Na2O, CH4
C. NH3, H2O, Na2O, CH4
D. K2S, MgCl2, Na2O
Chất có liên kết ion là K2S, MgCl2, Na2O
Câu 5. Cấu hình electron của cặp nguyên tử nào sau đây có thể tạo liên kết ion:
A. 1s22s22p3 và 1s22s22p5
B.1s22s1 và 1s22s22p5
C. 1s22s1 và 1s22s22p63s23p2
D.1s22s22p1 và 1s22s22p63s23p6
Cấu hình electron của cặp nguyên tử nào sau đây có thể tạo liên kết ion là 1s22s1 và 1s22s22p5
Câu 6. Cho 3 ion: Na+, Mg2+, F-. Tìm câu khẳng định sai.
A. 3 ion trên có cấu hình electron giống nhau.
B. 3 ion trên có số neutron khác nhau.
C. 3 ion trên có số electron bằng nhau
D. 3 ion trên có số proton bằng nhau.
D sai vì các ion là của các nguyên tố khác nhau nên số proton khác nhau
Chi tiết bộ câu hỏi luyện tập nằm trong FILE TẢI VỀ
---------------------------------








