Trắc nghiệm chương 1: Nguyên tử phần 6
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 1: Nguyên tử phần 6 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 1
Bài 1: Tổng số hạt mang điện trong hợp chất XY2 bằng 44. Số hạt mang điện của nguyên tử Y nhiều hơn số hạt mang điện của nguyên tử X là 4. số hiệu nguyên từ của X và Y lần lượt là
A. 5 và 9
B. 7 và 9
C. 8 và 16
D. 6 và 8
Chọn đáp án: D.
Giải thích:
Gọi tổng số hạt proton, nơtron và electron của nguyên tử X là : pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton, electron của nguyên tử XY2 là 44
Px + ex + 2.(py + ey)= 44 hay 2px + 4py = 44(1) px = ex và py = ey.
Số hạt mang điện của nguyên tử Y nhiều hơn số hạt mang điện của nguyên tử X là 4
2py – 2px = 4
Giải ra ta có px = 6(C) py= 8(O)
Bài 2: Hợp chất Y có công thức M4X3. Biết:
- Tổng số hạt trong phân tử Y là 214 hạt.
- Ion M3+ có số electron bằng số electron của ion X4-
- Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố M nhiều hơn tổng số hạt của nguyên tử nguyên tố X trong Y là 106. Y là chất nào dưới đây?
A. Al4Si3 B. Fe4Si3 C. Al4C3 D. Fe4C3
Chọn đáp án: C.
Giải thích:
Tổng số hạt trong phân tử Y là 214 hạt.
4(2pM + nM) + 3(2pX + nX) = 214 (1)
Ion M3+ có số electron bằng số electron của ion X4-
pM - 3 = pX + 4 => pX = pM - 7 (2)
Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố M nhiều hơn tổng số hạt của nguyên tử nguyên tố X trong Y là 106
4(2pM + nM) - 3(2pX + nX) = 106 (3)
(1),(3) ---> 2pM + nM = 40 (4) và 2pX + nX = 18 (5)
(5),(2),(4) ---> pX = 6 ; pM = 13 ---> X la C (Carbon) va M la Al (Nhôm)
Y la Al4C3 (Nhôm carbua)
Bài 3: Phát biểu nào dưới đây là đúng với nguyên tử X có số hiệu nguyên tử là 9?
A. Điện tích của lớp vỏ nguyên tử của X là 9+ .
B. Điện tích của hạt nhân nguyên tử X là 9+.
C. Tổng số hạt trong nguyên tử X là 26.
D. Số khối của nguyên tử X là 17.
Chọn đáp án: B.
Bài 4: Tổng số electron ở các phân lớp 3p và 3d của ion 26Fe3+ là
A. 10. B. 11. C. 12. D. 13.
Chọn đáp án: B.
Giải thích:
Cấu hình e của Fe: 1s22s22p63s23p63d64s2
Fe3+ 1s22s22p63s23p63d5
Phân lớp 3p có 6e, phân lớp 3d có 5e
Bài 5: Một ion M3+ có tổng số hạt proton, nơtron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cấu hình electron của nguyên tử M là
A. [Ar]3d54s1.
B. [Ar]3d64s2.
C. [Ar]3d64s1.
D. [Ar]3d34s2.
Chọn đáp án: D.
Giải thích:
Tổng số các loại hạt proton, nơtron và electron của ion M3+ là 79
P + n + e -3 = 79 2p + n = 82 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 19
P + e – 3 – n = 19 hay 2p – n = 22 (2)
Từ (1), (2) ta có p = e = 26, n =30
Cấu hình e của M: [Ar]3d64s2.
Bài 6: Nguyên tử khối trung bình của clo là 35,5. Clo trong tự nhiên có 2 đồng vị là 35Cl và 37Cl. Phần trăm về khối lượng của 3717Cl chứa trong HClO4 (với hiđro là đồng vị 11H, oxi là đồng vị 168O) là giá trị nào sau đây
A. 9,40%. B. 8,95%. C. 9,67%. D. 9,20%.
Chọn đáp án: D.
Giải thích:
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có
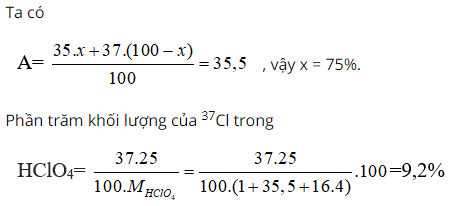
Bài 7: Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Các nguyên tố X và Y lần lượt là
A. Fe và Cl.
B. Na và Cl.
C. Al và Cl.
D. Al và P.
Chọn đáp án: C.
Giải thích:
Cấu hình electron của X: 1s22s22p63s23p1 (Al)
Số hạt mang điện của X = 12.2=26
Số hạt mang điện của Y = 26+8 = 34 , py = 17 (Cl)
Bài 8: Hạt nhân của ion X+ có điện tích là 30,4.10-19 culông. Xác định nguyên tử X.
A. Na B. K C. Mg D. Ca
Chọn đáp án: B.
Giải thích:
Theo giả thiết : Hạt nhân của ion X+ có điện tích là 30,4.10-19 C nên nguyên tử X cũng có điện tích hạt nhân là 30,4.10-19 C. Mặt khác mỗi hạt proton có điện tích là 1,6.10-19 C nên suy ra số prton trong hạt nhân của X là :
Số hạt 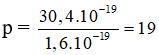 . Vậy nguyên tử X là Kali (K).
. Vậy nguyên tử X là Kali (K).
Bài 9: Hiđrô có ba đồng vị 1H, 2H, 3H. Oxi có ba đồng vị 16O, 17O, 18O. Trong nước tự nhiên, loại phân tử nước có klg nhỏ nhất là?
A. 18u B. 20u C. 17u D. 19u
Chọn đáp án: A.
Giải thích: Đồng vị H2O nhỏ nhất sẽ được tạo thành bởi đồng vị H và đồng vị O có khối lượng nhỏ nhất là 1H1H16O.
Bài 10: Nguyên tố M có các đồng vị sau:
![]()
Đồng vị phù hợp với tỷ lệ số proton/số nơtron = 13/15 là
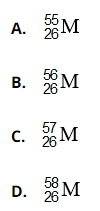
Chọn đáp án:
Giải thích:
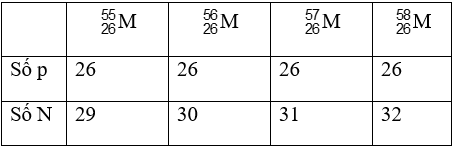
Đồng vị phù hợp với tỷ lệ số proton/số nơtron = 13/15 là![]()
Bài 11: Cho 5 nguyên tử:![]() Hai nguyên tử nào có cùng số nơtron?
Hai nguyên tử nào có cùng số nơtron?
A. A và B
B. B và D
C. A và C
D. B và E
Chọn đáp án:
Giải thích:
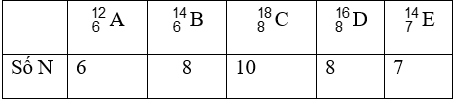
Bài 12: Trong tự nhiên Clo có 2 đồng vị 35Cl và 37Cl. Nguyên tử khối trung bình của Clo là 35,5. Phần trăm về khối lượng của 35Cl trong HClO là
A. 50,00%.
B. 48,67%.
C. 51,23%.
D. 55,20%
Chọn đáp án: A.
Giải thích:
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có
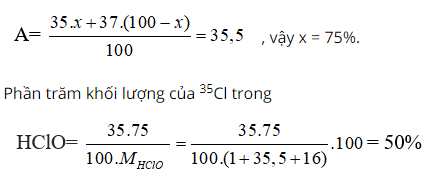
Bài 13: Một nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron lớp ngoài cùng là 6. Cho biết X thuộc về nguyên tố hoá học nào sau đây?
A. Oxi (Z = 8)
B. Lưu huỳnh (Z = 16)
C. Flo (Z = 9)
D. Clo (Z = 17)
Chọn đáp án: B
Giải thích: Cấu hình đầy đủ của X: 1s22s22p63s23p4
Bài 14: Một nguyên tử X có tổng số e ở các phân lớp p là 11. Hãy cho biết X thuộc về nguyên tố hoá học nào sau đây?
A. nguyên tố s.
B. nguyên tố p.
C. nguyên tố d.
D. nguyên tố f.
Chọn đáp án: B.
Giải thích: Cấu hình của X là 1s22s22p63s23p5
Bài 15: Nguyên tử nguyên tố X có electron cuối cùng được phân bổ vào phân lớp 3p1. Nguyên tử nguyên tố Y có electron cuối cùng được phân bổ vào phân lớp 3p3. Số proton của X, Y lần lượt là :
A. 13 và 15
B. 12 và 14
C. 13 và 14
D. 12 và 15
Chọn đáp án: A.
Giải thích:
Cấu hình electron đầy đủ của X: 1s22s22p63s23p1 Số p= 13
Cấu hình electron đầy đủ của Y: 1s22s22p63s23p3 số p = 15
Bài 16: Trong các cấu hình electron dưới đây, cấu hình nào không tuân theo nguyên lí Pauli?
A. 1s22s1
B. 1s22s22p5
C. 1s22s22p63s2
D. 1s22s22p73s2
Chọn đáp án: D
Giải thích: Phân lớp p chỉ được chứa tối đa 6e
Bài 17: Nguyên tử nguyên tố X tạo ion X−. Tổng số hạt (p, n, e) trong X− bằng 116. X là nguyên tử nguyên tố nào dưới đây?
A. 34Se B. 32Ge C. 33As D. 35Br
Chọn đáp án: D.
Giải thích:
X− có tổng số hạt bằng = 116, vậy X có tổng số hạt = 115.
Ta có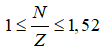
2p + n = 115 => n = 115 – 2p, thay vào (1) ta có
![]()
Giải ra ta có p = n =35 (Br)
Bài 18: Tổng số hạt p, n và electron trong ng.tử của 1 nguyên tố là 21. Nguyên tố là:
A. Oxi
B. Cacbon
C. Nitơ
D. Tất cả đều sai
Chọn đáp án: C
Giải thích:
Ta có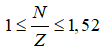
2p + n = 21 => n = 21 – 2p, thay vào (1) ta có
![]()
Giải ra ta có p = n =7
Bài 19: Tổng số hạt cơ bản trong M2+ là 90, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. M là
A. Cr. B. Cu. C. Fe. D. Zn.
Chọn đáp án:
Giải thích:
Tổng số các loại hạt proton, nơtron và electron của M2+ là 90
P + n + e -2 = 90 2p + n = 92 (1)
Tổng số hạt mang điện gấp nhiều hơn số hạt không mang điện là 22
(P + e - 2) – n = 22 hay 2p – n = 24 (2)
Từ (1), (2) ta có p = e = 29 , n =34
Bài 20: Nguyên tử Cu có 35 electron ở vỏ nguyên tử. Điện tích hạt nhân của nguyên tử đồng (theo đơn vị C) là
A. +79.
B. -79.
C. -5,607.10-18 C.
D. +5,607.10-18 C.
Chọn đáp án: D.
Giải thích:
Có p=e=35
Điện tích hạt nhân của nguyên tử đồng là: qp= 35+= 35. 1,602.10-19 = 5,607.10-18
Bài 21: Nguyên tử X có tổng số hạt p, n, e là 28 hạt. Kí hiệu nguyên tử của X là Điện tích hạt nhân = 35. +1,602.10-19 = +5,607.10-18
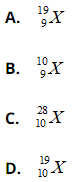
Chọn đáp án: A.
Giải thích:
Ta có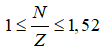
2p + n = 28 => n = 28 – 2p, thay vào (1) ta có
![]()
Giải ra ta có p = 9, N = 10.
Bài 22: Theo định nghĩa, số Avogađro là một số bằng số nguyên tử đồng vị 12C có trong 12 gam đồng vị 12C. Số Avogađro được kí hiệu là N, N có giá trị là 6,023.1023. Khối lượng của một nguyên tử 12C là bao nhiêu gam
A. 12gam
B. 6gam
C. 1,655.10-27 gam
D. 1,9924.10-23 gam
Chọn đáp án: D.
Giải thích:
Khối lượng của một nguyên tử cacbon 12,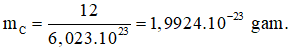
Sử dụng giả thiết sau, trả lời các câu hỏi 63,64.
Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau :
| Đồng vị | 24Mg | 25Mg | 26Mg |
|---|---|---|---|
| % | 78,6 | 10,1 | 11,3 |
Bài 23: Nguyên tử khối trung bình của Mg là
A. 24 B. 24,33 C. 25 D. 25,5
Chọn đáp án: B
Bài 24: Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, thì số nguyên tử tương ứng của hai đồng vị 24, 26 lần lượt là bao nhiêu?
A. 48 và 52
B. 56 và 389
C. 389 và 56
D. 52 và 48
Chọn đáp án: C
Giải thích:
Do electron có khối lượng rất nhỏ nên nguyên tử khối trung bình của Mg xấp xỉ bằng số khối trung bình của nó:
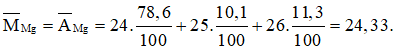
Tính số nguyên tử của các đồng vị 24Mg và 26Mg:
Ta có:
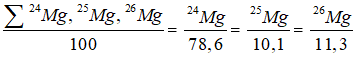
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, thì số nguyên tử tương ứng của 2 đồng vị còn lại là :
Bài 25: Cấu hình electron biểu diễn theo ô lượng tử nào dưới đây không đúng?
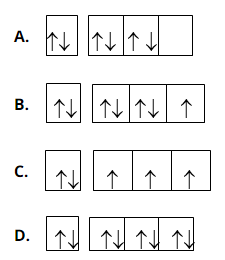
Chọn đáp án: A.
Giải thích:
Các electron phải phân bố sao cho số electron độc thân là lớn nhất (Quy tắc Hun)
Bài 26: Nguyên tử của nguyên tố A và B đều có phân lớp ngoài cùng là 2p. Tổng số e ở hai phân lớp ngoài cùng hai nguyên tử này là 3. Vậy số hiệu nguyên tử của A và B lần lượt là:
A. 1 & 2 B. 5 & 6 C. 7 & 8 D. 7 & 9
Chọn đáp án: B
Giải thích:
Cấu hình của A và B là:
1s22s22px và 1s22s22py
x+y = 3 => x = 1 , y =2 => PA = 5, PB = 6
Bài 27: Trong nước, hiđro tồn tại hai đồng vị 1H và 2H. Biết nguyên tử khối trung bình của hiđro là 1,008; của oxi là 16. Số nguyên tử đồng vị của 2H có trong 1 ml nước nguyên chất (d = 1 gam/ml) là bao nhiêu?
A. 18,016.1023
B. 5,35.1020
C. 6,023.1023
D. 1,204.1020
Chọn đáp án: B
Giải thích:
Áp dụng sơ đồ đường chéo ta có :
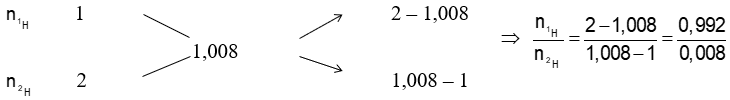
Vậy phần trăm về số nguyên tử của các đồng vị H là : %1H=99,2%; %2H=0,8%

Bài 28: Trong tự nhiên kali có hai đồng vị![]() Tính thành phần phần trăm về khối lượng của 3919K có trong KClO4.
Tính thành phần phần trăm về khối lượng của 3919K có trong KClO4.
A. 63% B. 93,5% C. 26,3% D. 1,82%
Chọn đáp án: C.
Giải thích:
Gọi phần trăm về số nguyên tử đồng vị (phần trăm về số mol) của ![]() là x1 và x2 ta có:
là x1 và x2 ta có:
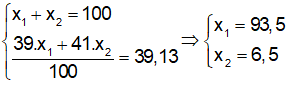
Giả sử có 1 mol KClO4 thì tổng số mol các đồng vị của K là 1 mol, trong đó số mol là 1.0,935 =0,935 mol.
Vậy thành phần phần trăm về khối lượng của 3919K có trong KClO4 là:
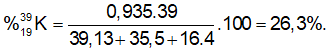
Bài 29: Nguyên tử của một nguyên tố có bốn lớp electron, theo thứ tự từ phía gần hạt nhân là : K, L, M, N. Trong nguyên tử đã cho, electron thuộc lớp nào có mức năng lượng trung bình cao nhất ?
A. Lớp K. B. Lớp L. C. Lớp M. D. Lớp N.
Chọn đáp án: D.
Giải thích: Càng xa hạt nhân, electron càng có mức năng lượng cao.
Bài 30: Cho biết cấu hình electron của X: 1s22s22p63s23p3 của Y là 1s22s22p63s23p64s1. Nhận xét nào sau đây là đúng?
A. X và Y đều là các kim loại.
B. X và Y đều là các phi kim.
C. X và Y đều là các khí hiếm.
D. X là một phi kim còn Y là một kim loại
Chọn đáp án: D.
Giải thích:
X có 5 electron lớp ngoài cùng nên X là phi kim.
Y có 1 electron lớp ngoài cùng nên Y là kim loại.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 1: Nguyên tử phần 6. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








