Bài tập Hóa 10 Chương 1: Cấu tạo nguyên tử
Đây là tài liệu Cao cấp - Chỉ dành cho Thành viên VnDoc ProPlus.
- Tải tất cả tài liệu lớp 10 (Trừ Giáo án, bài giảng)
- Trắc nghiệm không giới hạn
Bài tập cấu tạo nguyên tử lớp 10
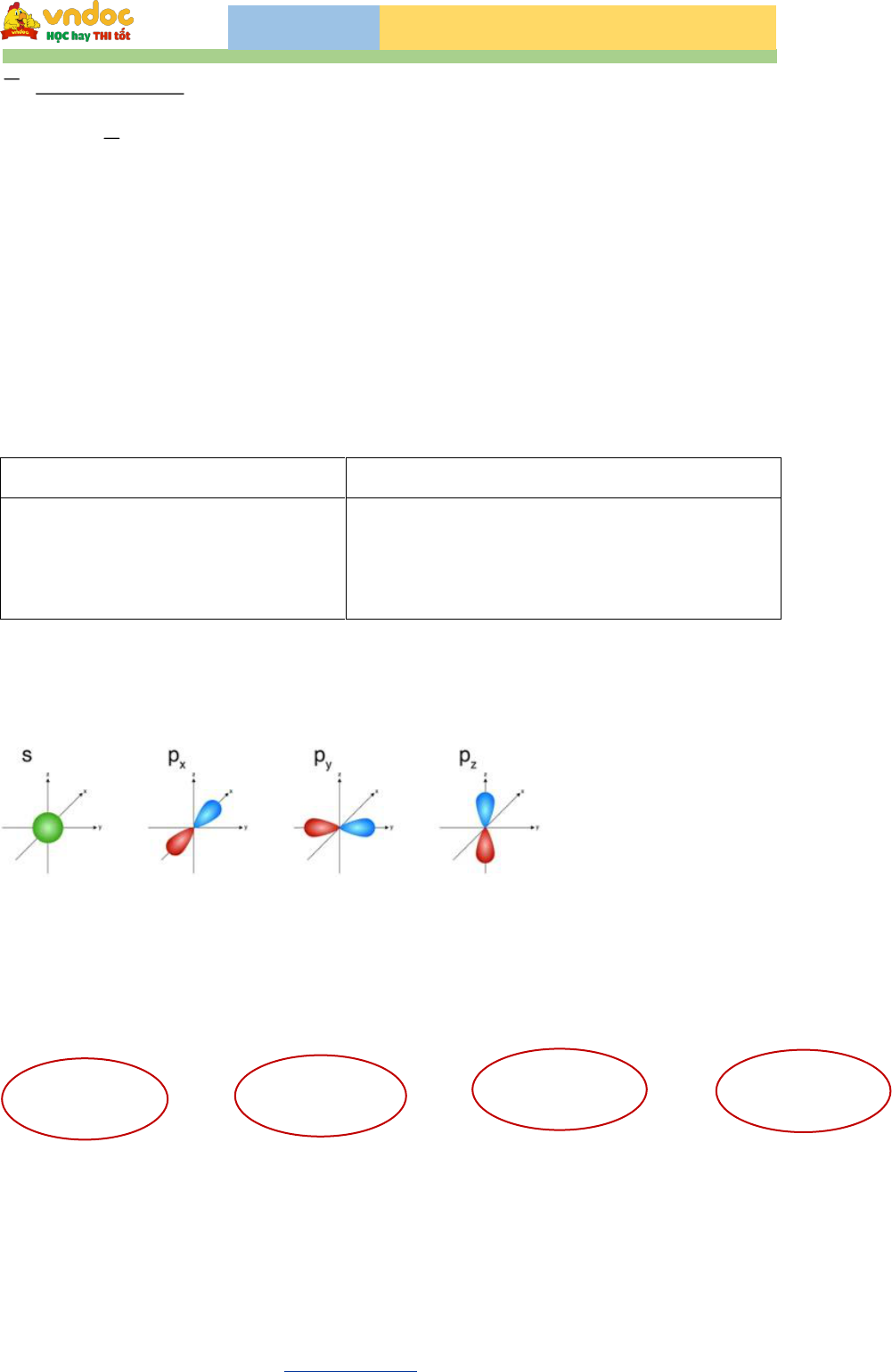
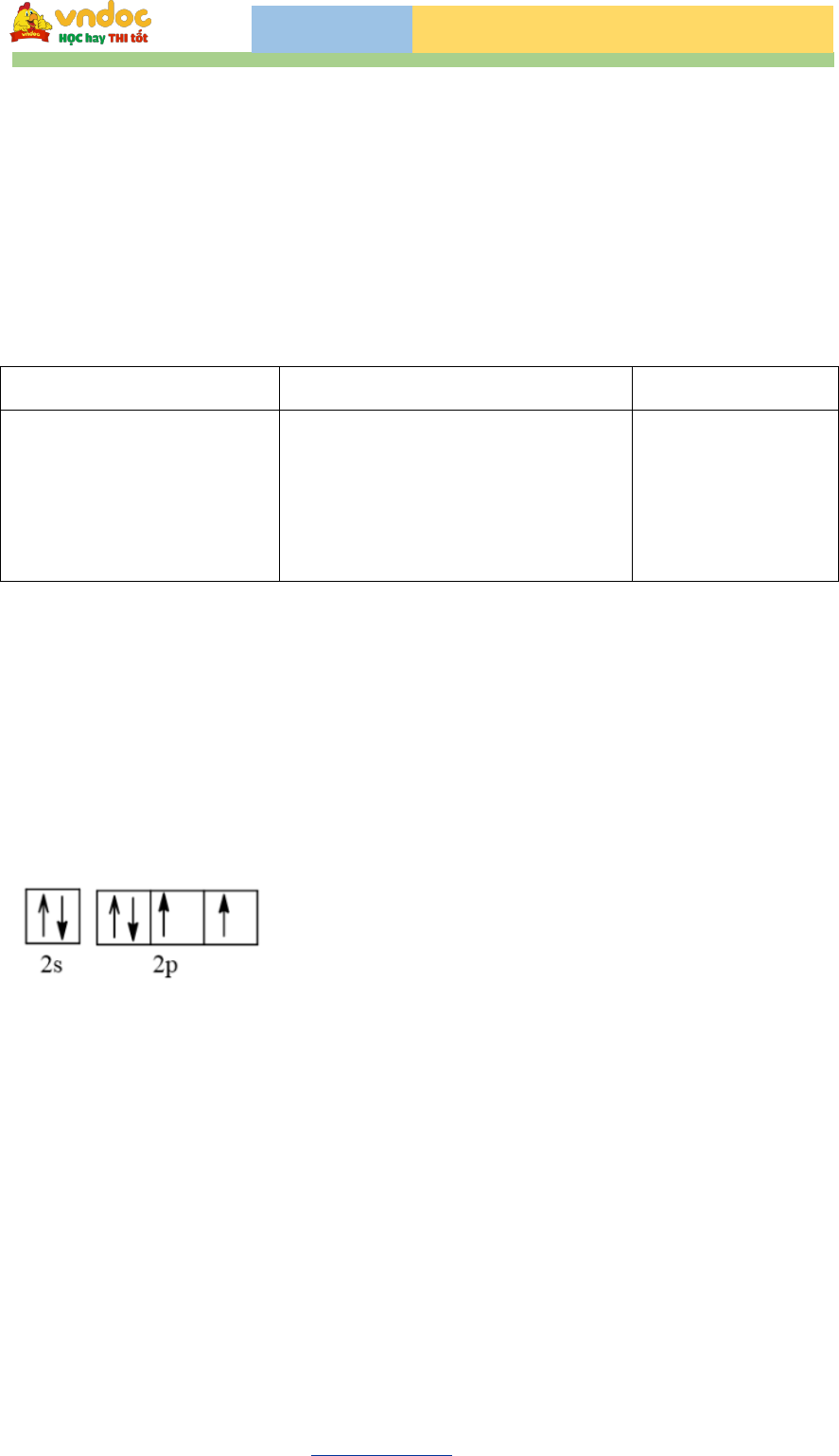
Bài tập Hóa 10 chương 1: Cấu tạo nguyên tử là phần kiến thức nền tảng giúp học sinh hiểu rõ về cấu trúc nguyên tử, cách tính số hạt proton, electron, neutron và phân biệt giữa nguyên tố, đồng vị, ion. Nội dung dưới đây sẽ cung cấp hệ thống bài tập cấu tạo nguyên tử lớp 10 theo từng dạng cơ bản đến nâng cao, kèm lý thuyết trọng tâm và lời giải chi tiết, giúp các em dễ dàng ôn tập, luyện thi hiệu quả.




