Trắc nghiệm chương 1: Nguyên tử phần 4
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 1: Nguyên tử phần 4 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 1
Bài 1: Một nguyên tử có 9 electron và hạt nhân của nó có 10 nơtron. Số hiệu của nguyên tử đó là bao nhiêu?
A. 9 B. 18 C. 19 D. 28
Chọn đáp án: A
Giải thích: Số hiệu nguyên tử = số hạt p = số hạt e.
Bài 2: Nguyên tử nguyên tố X có số khối bằng 23, số hiệu nguyên tử bằng 11. X có
A. số proton là 12.
B. số nơtron là 12.
C. số nơtron là 11.
D. tổng số nơtron và proton là 22.
Chọn đáp án: B
Giải thích:
Số hiệu nguyên tử = số hạt p.
Số khối A = Z + N => N = A – Z = 23 – 11 = 12 hạt
Bài 3: Một nguyên tố của nguyên tử X có tổng số hạt (p, n, e) bằng 52 và có số khối là 35. Số hiệu nguyên tử của nguyên tố X là
A. 17 B. 20 C. 18 D. 16
Chọn đáp án: A.
Giải thích:
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố X là 52:
P + e + n = 52 hay 2p + n = 52 (do p = e) (1)
Số khối bằng 35
P + n = 35 (2)
Giải (1), (2) ta có p = e = 17; n =18
Bài 4: Nguyên tố A được kí hiệu như sau:![]() . Số hạt nơtron trong A là:
. Số hạt nơtron trong A là:
A. 19 B. 39 C. 20 D. 58
Chọn đáp án: C.
Giải thích: A = Z + N => N = A – Z = 39 – 19 = 20 hạt.
Bài 5: Cấu hình e của nguyên tố canxi (Z=20) là 1s22s22p63s23p64s2. Tìm câu sai?
A. Lớp K có 2e.
B. Lớp L có 8e
C. Lớp M có 6e.
D. Lớp N có 2e.
Chọn đáp án: C.
Giải thích: Lớp M có 8e.
Bài 6: Nguyên tử ![]() có số khối là bao nhiêu?
có số khối là bao nhiêu?
A. 9 B. 10 C. 19 D. 28
Chọn đáp án: A.
Bài 7: Một nguyên tử có 9 electron ở lớp vỏ, hạt nhân của nó có 10 nơtron. Số hiệu nguyên tử đó là
A. 9. B. 18. C. 19. D. 28.
Chọn đáp án: A.
Giải thích: Số hiệu nguyên tử = số hạt p = số hạt e.
Bài 8: Hạt nhân của nguyên tử 6529Cu có số nơtron là:
A. 65 B. 29 C. 36 D. 94
Chọn đáp án: C.
Giải thích: A = Z + N => N = A – Z = 65 – 29 = 36 hạt.
Bài 9: Đồng có đồng vị 63Cu (69,1%) và 65Cu. Nguyên tử khối trung bình của đồng là:
A. 64,000(u)
B. 63,542(u)
C. 64,382(u)
D. 63,618(u)
Chọn đáp án: D
Giải thích:
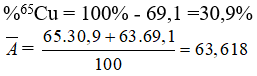
Bài 10: A, B là nguyên tử đồng vị. A có số khối bằng 24 chiếm 60%, nguyên tử khối trung bình của hai đồng vị là 24,4. Số khối của đồng vị B là:
A. 26 B. 25 C. 23 D. 27
Chọn đáp án: B
Giải thích:
Gọi số khối của đồng vị thứ 2 là x
Đồng vị có số khối 24 chiếm 60%, vậy đồng vị còn lại chiếm 40%
Ta có![]() , vậy x = 25
, vậy x = 25
Bài 11: Một đồng vị của nguyên tử photpho![]() có số proton là:
có số proton là:
A. 32 B. 15 C. 47 D. 17
Chọn đáp án: B.
Bài 12: Nguyên tử 199F khác với nguyên tử![]() là nguyên tử
là nguyên tử![]()
A. Hơn nguyên tử F 13p
B. Hơn nguyên tử F 6e
C. Hơn nguyên tử F 6n
D. Hơn nguyên tử F 13e
Chọn đáp án: B.
Giải thích:

Bài 13: Nguyên tử X có điện tích hạt nhân là +2,7234.10-18C. Trong nguyên tử X số hạt mang điện nhiều hơn số hạt không mang điện là 16. Kí hiệu nguyên tử của X là
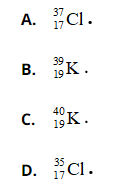
Chọn đáp án: A
Giải thích:
Điện tích hạt nhân = số p . (+1,602.10-19) = +2,7234.10-18C
Số p = 17, số n = 17 + 16 = 35
Bài 14: Tống số hạt p, n, e trong nguyên tử của một nguyên tố X là 20. Trong đó, số hạt không mang điện nhiều hơn số hạt mang điện dương là 2 đơn vị. Số khối A của X:
A. 14. B. 12. C. 16. D. 22.
Chọn đáp án: A
Giải thích:
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố X là 20:
p + e + n = 20 hay 2p + n = 20 (do p = e) (1)
Số hạt không mang điện (n) nhiều hơn số hạt mang điện dương (p) là 2 hạt
n - p = 2 (2)
Giải (1), (2) ta có p = e = 6; n =8
Số khối của X = Z + N = p + n =14
Bài 15: Một nguyên tử nguyên tố R có tổng số hạt mang điện và không mang điện là 34, trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện. Số hạt proton trong nguyên tố R là
A. 12 B. 11 C. 23 D. 14
Chọn đáp án: B.
Giải thích:
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố R là 34:
p + e + n = 34 hay 2p + n = 34 (do p = e) (1)
Số mang điện (p và e) gấp 1,833 lần số hạt không mang điện (n)
p + e = 1,833n hay 2p = 1,833n (do p = e) (2)
Giải (1), (2) ta có p = e =11 ; n = 12
Bài 16: Nguyên tử các nguyên tố X, Y, Z có cấu hình electron là
X : 1s22s22p63s23p4
Y : 1s22s22p63s23p6
Z : 1s22s22p63s23p64s2
Trong các nguyên tố X, Y, Z nguyên tố kim loại là
A. X. B. Y. C. Z. D. X và Y.
Chọn đáp án: C.
Giải thích: Kim loại là những nguyên tố có 1, 2, 3 electron lớp ngoài cùng.
Bài 17: Cấu hình electron nào dưới đây không đúng?
A. C (Z = 6): [He] 2s22p2
B. Cr (Z = 24): [Ar] 3d54s1
C. O2− (Z = 8): [He] 2s22p4
D. Fe (Z = 26): [Ar] 3d64s2
Chọn đáp án: C
Giải thích: Cấu hình của O: [He] 2s22p4 → O2-: [He] 2s22p6
Bài 18: Nhận định nào không đúng? Hai nguyên tử 6329Cu và 6529Cu
A. là đồng vị của nhau.
B. có cùng số electron.
C. có cùng số nơtron.
D. có cùng số hiệu nguyên tử
Chọn đáp án: C.
Giải thích: ![]()
Bài 19: Tổng số hạt proton, nơtron, electron trong nguyên tử![]() là
là
A. 115. B. 80. C. 35. D. 60.
Chọn đáp án: A.
Giải thích:
Br có số hạt p = e = 35.
Số hạt n = 80 – 35 = 45.
Tổng số hạt = p + n + e = 115 hạt.
Bài 20: Câu nào sau đây sai?
A. Các đồng vị phải có số khối khác nhau.
B. Các đồng vị phải có số nơtron khác nhau.
C. Các đồng vị phải có cùng điện tích hạt nhân.
D. Các đồng vị phải có số electron khác nhau
Chọn đáp án: D.
Giải thích: Đồng vị có cùng số p = e.
Bài 21: Những nguyên tử![]() có cùng:
có cùng:
A. Số hiệu nguyên tử
B. Số e
C. Số nơtron
D. Số khối
Chọn đáp án: C.
Bài 22: Một nguyên tử có 8P, 8E và 8N. Chọn nguyên tư đồng vị với nó.
A. 8P, 8N, 9E.
B. 8P, 9N, 9E.
C. 9P, 8N, 9E.
D. 8P, 9N, 8E.
Chọn đáp án: D.
Bài 23: Lớp E nào có số E tối đa là 18 E.
A. n=1. B. n=2. C. n=3. D. n=4.
Chọn đáp án: C.
Giải thích: Lớp M (n=3).
Bài 24: Nguyên tử 27X có cấu hình 1s22s22p63s2 3p1. Hạt nhân nguyên tử X có.
A. 14N, 13P, 13E
B. 13P, 14N.
C. 13N, 14P.
D. 13P, 14E, 13N
Chọn đáp án: B
Bài 25: Ion M3+ có cấu hình electron phân lớp ngoài cùng là 3d5. Vậy cấu hình electron của M là
A. 1s22s22p63s23p64s23d8
B. 1s22s22p63s23p63d64s2
C. 1s22s22p63s23p63d8
D. 1s22s22p63s23p63d54s24p1
Chọn đáp án: B.
Giải thích: Nguyên tử M đã nhường đi 3 electron để tạo ion M3+
Bài 26: Ion X2- và M3+ đều có cấu hình electron là 1s22s22p6. X, M là những nguyên tử nào sau đây?
A. F, Ca B. O, Al C. S, Al D. O, Mg
Chọn đáp án: B.
Giải thích:
Cấu hình electron của X: 1s22s22p4 (Oxi)
Cấu hình electron của M: 1s22s22p63s23p1 (Al)
Bài 27: Lớp e ngoài cùng của kim loại kiềm được biểu thị chung là:
A. np1. B. ns2 C. ns2np1 D. Tất cả đều sai.
Chọn đáp án: D
Giải thích: Kim loại kiềm có 1 electron lớp ngoài cùng, cấu hình phù hợp là ns1
Bài 28: Số proton, nơtron, electron trong nguyên tử![]() lần lượt là:
lần lượt là:
A. 17, 35, 18
B. 17, 18, 18
C. 35, 17, 18
D. 17, 20, 17
Chọn đáp án: D
Giải thích:
Nguyên tử Clo có p = Z = e = 17 (hạt)
N = A- Z = 37 – 17 = 20 (hạt)
Bài 29: Nhận định nào sau đây đúng khi nói về 3 nguyên tử:![]() ?
?
A. X và Y có cùng số n
B. X, Z là 2 đồng vị của cùng một nguyên tố hóa học.
C. X, Y thuộc cùng 1 nguyên tố hóa học.
D. X, Z có cùng số khối.
Chọn đáp án: D.
Bài 30: Hạt nhân của nguyên tử nào có số hạt nơtron là 28?
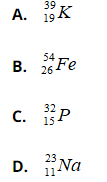
Chọn đáp án: B.
Giải thích:
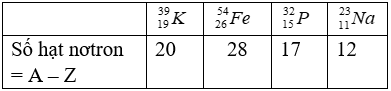
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 1: Nguyên tử phần 4. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








