Trắc nghiệm chương 2: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn phần 4
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 2: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn phần 4 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 2
Bài 1: Nguyên tố R có hóa trị cao nhất trong oxit gấp 3 lần hóa trị trong hợp chất với hiđro. Hãy cho biết hóa trị của R trong hợp chất với hidro.
A. 5 B. 6 C. 3 D. 2
Chọn đáp án: D
Giải thích:
Gọi hóa trị cao nhất của R trong oxit là m, hóa trị trong hợp chất với hiđro là n. Ta có: m + n = 8.
Theo bài: m = 3n. Từ đây tìm được m = 6; n = 2.
⇒ Hóa trị của R với H là 2, CT: RH2
Bài 2: Oxit cao nhất của nguyên tố R thuộc nhóm VIA có 60% oxi về khối lượng. Hãy xác định nguyên tố R và viết công thức oxit cao nhất.
A. SO2 B. SO3 C. PO3 D. SeO3
Chọn đáp án: B
Giải thích:
Nhóm VIA nên hợp chất oxit bậc cao là RO3
Theo bài ta có: R/ 48 = 40/60 ⇒ R= 32 ( Lưu huỳnh)
⇒ Công thức Oxit cao nhất là : SO3
Bài 3: Nguyên tử R tạo được Cation R+. Cấu hình e của R+ ở trạng thái cơ bản là 3p6. Tổng số hạt mang điện trong R là.
A. 18 B. 22 C. 38 D. 19
Chọn đáp án: C
Giải thích:
Cấu hình của R+ là 3p6
⇒ R sẽ là 3p64s1
⇒ R có cấu hình đầy đủ là 1s22s22p63s23p64s1
⇒ Tổng hạt mang điện trong R là (p + e) = 38
Bài 4: Cho biết cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố (thuộc chu kỳ 3) M là ns2np1. Xác định M
A. B B. Al C. Mg D. Na
Chọn đáp án: B
Giải thích:
M thuộc chu kì 3 nên có n = 3.
Cấu hình electron M: 1s22s22p63s23p1 (ô số 13, nhóm IIIA), M là kim loại Al.
Bài 5: R thuộc chu kì 2 nhóm VA của bảng tuần hoàn. Cho biết cấu hình electron của R có bao nhiêu electrons?
A. 2 B. 4 C. 3 D. 6
Chọn đáp án: B
Giải thích:
R thuộc chu kì 2 ⇒ Có 2 lớp electron.
R thuộc nhóm VA ⇒ Có 5 electron lớp ngoài cùng
⇒ Cấu hình electron của R: ls22s22p3 ⇒ có 4 e thuộc phân lớp s
Bài 6: Cho 8,8 gam một hỗn hợp hai kim loại nằm ở hai chu kì liên tiếp nhau và thuộc nhóm IIIA, tác dụng với HCl dư thì thu được 6,72 lít khí hidro (đktc). Dựa vào bảng tuần hoàn cho biết tên hai kim loại đó.
Giải thích:
Đặt CT chung của 2 kim loại nhóm IIIA là M, nguyên tử khối trung bình là M−
Phương trình hóa học có dạng: 2M + 6HCl → 2MCl3 + 3H2
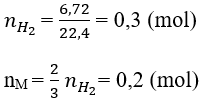
theo đầu bài: M− .0,2=8,8 → M−=44
2 kim loại thuộc hai chu kì liên tiếp của nhóm IIIA, một kim loại có nguyên tử khối nhỏ hơn 44 và một kim loại có nguyên tử khối lơn hơn 44.
⇒ 2 KL là: Al (M = 27 < 44) và Ga (M = 69,72 > 44).
Bài 7: Hỗn hợp A gồm 2 kim loại X, Y thuộc hai chu kì liên tiếp ở phân nhóm IIA. Cho 2,64 gam A tác dụng hết với dung dịch H2SO4 loãng thu dược 2,016 khí (đktc). Xác định X, Y.
A. Mg, Ca B. Be, Mg C. Ca, Ba D. Ca, Sr
Chọn đáp án: A
Giải thích:
Thay thế hỗn hợp kim loại bằng một kim loại tương đương M−.
Số mol H2 = 0,09 (mol)
M− + H2SO4 → M−SO4 + H2
(mol) 0,09 ← 0,09
![]()
⇒ Mg =24 < 29, 33 < 40=Ca
X, Y là Mg, Ca.
Bài 8: Một nguyên tố R có cấu hình electron: 1s22s22p63s23p4, công thức hợp chất của R với hiđro và công thức oxit cao nhất là:
A. RH2, RO. B. RH2, RO3. C. RH2, RO2. D. RH5, R2O5.
Chọn đáp án: B
Giải thích:
R có 6e lớp ngoài cùng nên có hóa trị cao nhất với oxi là 6, hóa trị với hidro là 8-6=2
⇒ CT: RH2 và RO3
Bài 9: Cho 10 gam kim loại A (thuộc nhóm IIA) tác dụng với nước, thu được 5,6 lit H2. Hãy xác định tên của kim loại M đã dùng.
A. Ca B. Mg C. Ba D. Br
Chọn đáp án: A
Giải thích:
A + 2H2O → A(OH)2 + H2
Số mol khí H2 = 0,25 (mol) ⇒ nA = 0,25 (mol)
Ta có: MA = 10 / 0,25 = 40 (Ca).
Bài 10: Oxit cao nhất của một nguyên tố ứng với công thức RO3. Hợp chất của nó với hidro có 5,88% H về khối lượng. Xác định R.
A. P B. S C. C D. Se
Chọn đáp án: B
Giải thích:
Oxit cao nhất là RO3 → R thuộc nhóm VIA.
Hợp chất với hidro có dạng RH2.
![]()
Đó là nguyên tố lưu huỳnh (S).
Bài 11: Hòa tan hoàn toàn 6,645 gam hỗn hợp muối clorua của hai kim loại kiềm thuộc hai chu kì kế tiếp nhau vào nước được dung dịch X. Cho toàn bộ dung dịch X tác dụng hoàn toàn với dung dịch AgNO3 (dư), thu được 18,655 gam kết tủa. Tìm 2 kim loại kiềm.
A. Na, K B. Li, Be C. Li, Na D. K, Rb
Chọn đáp án: C
Giải thích:
Ta có:![]()
M−Cl + AgNO3 → M−NO3 + AgCl
0,13 mol 0,13 mol
⇒ (M−+35,5).0,13 = 6,645 → M−=15,62
Mà 2 kim loại kiềm thuộc hai chu kì kế tiếp nhau → Li (7) và Na(23)
Bài 12: Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của nguyên tố X với hidro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là
A. 50% B. 27,27% C. 60% D. 40%
Chọn đáp án: D
Giải thích:
X có cấu hình electron lớp ngoài cùng là ns2np4 → hợp chất khí của X với H là XH2
Trong XH2, X chiếm 94,12% về khối lượng nên ta có
![]() 100% = 94,12% → X= 32 → X là Lưu huỳnh
100% = 94,12% → X= 32 → X là Lưu huỳnh
Oxit cao nhất của S là SO3 → %S = (32/80) 100% = 40%
Bài 13: Oxit cao nhất của nguyên tố R có dạng R2O7. Sản phầm khí của R với hidro chứa 2,74% hidro về khối lượng. Xác định hợp chất của R với H.
A. HCl B. HBr C. H2S D. CH4
Chọn đáp án: A
Giải thích:
Oxit cao nhất của nguyên tố R có công thức R2O7.
→ Công thức hợp chất khí với hidro có dạng RH theo đề:
%H = 1/(R+1) . 100% = 2,74%
⇒ R = 35,5 (clo)
→ Công thức phân tử của oxit là Cl2O7
Công thức hợp chất khí với hidro là HCl.
Bài 14: Khi cho 3,33 g một kim loại thuộc phân nhóm chính nhóm I tác dụng với nước thì có 0,48 g khí H2 thoát ra. Vậy kim loại trên là
A. Li B. Na C. K D. Ca
Chọn đáp án: A
Giải thích:
Phương trình phản ứng
2M + 2H2O → 2MOH + H2
Mol 0,48 0,24
M = 3,33/0,48 = 6,94 → M là Li
Bài 15: Cho 6,4 g hỗn hợp hai kim loại nhóm IIA, thuộc hai chu kì liên tiếp, tác dụng hết với dung dịch HCl dư thu được 4,48 lít khí hiđro (đktc). Các kim loại đó là
A. Be và Mg
B. Mg và Ca
C. Ca và Sr
D. Sr và Ba
Chọn đáp án: B
Giải thích:
Áp dụng phương pháp khối lượng mol trung bình, ta có
M= 6,4/0,2 = 32
→ 24= M1 < 32 < M2 = 40
Bài 16: Nguyên tử của nguyên tố M tạo được anion M2- có cấu hình electron ở phân lớp ngoài cùng là 3p6. Vị trí của nguyên tố M trong bảng tuần hoàn và công thức hợp chất có hóa trị cao nhất với oxi là:
A. ô số 8 chu kì 2 nhóm VIA, SO2
B. ô số 15 chu kì 3 nhóm VIA, SO3
C. ô số 16 chu kì 3 nhóm VIA, SO3
D. ô số 16 chu kì 3 nhóm IVA, SO2
Chọn đáp án: C
Giải thích: Vì M + 2e → M2- do đó cấu hình electron của M là 1s22s22p43s23p4 và ở ô số 16 chu kì 3 nhóm VIA. CT hợp chất có hóa trị cao nhất với oxi là SO3
Bài 17: Ba nguyên tố X,Y,Z thuộc cùng nhóm A và ở ba chu kì liên tiếp. Tổng số hạt proton trong ba nguyên tử bằng 70. Ba nguyên tố là nguyên tố nào sau đây
A. Be,Mg,Ca
B. Sr , Cd ,Ba
C. Mg,Ca,Sr
D. tất cả đều sai
Chọn đáp án: C
Giải thích:
Z− = 70/3 = 23,3. Vậy các nguyên tố thuộc chu kì 4 và 2 nguyên tố còn lại một thuộc chu kì 3 và một thuộc chu kì 5
Gọi Z là số proton của nguyên tố thuộc chu kì 3. Vậy nguyên tố thuộc chu kì 4 cùng nhóm A ở các chu kì 4 và 5 lần lượt là Z +8 và Z+8+18
3Z + 8+8+18 =70 ⟶ Z =12
3 nguyên tố có thứ tự lần lượt là 12, 20, 38 đó là Mg , Ca, Sr
Bài 18: Hai nguyên tố X,Y đứng kế tiếp nhau trong một chu kì thuộc bảng tuần hoàn, có tổng điện tích dương là 25. Vị trí của X và Y trong bảng tuần hoàn là vị trí nào sau đây
A. X chu kì 3, nhóm IIA, Y chu kì 2, nhóm IIIA
B. X chu kì 3, nhóm IIA, Y chu kì 3, nhóm IIIA
C. X chu kì 2, nhóm IIIA, Y chu kì 3 nhóm IIIA
D. tất cả đều sai
Chọn đáp án: B
Giải thích:
Theo đầu bài hai nguyên tố kế tiếp nhau nên cách nhau một điện tích dương. Giả sử ZX, ZY là số proton của X và Y
ZX = (25-1)/2 = 12, ZY = 13
Cấu hình electron của X 1s22s22p63s2 , X ở chu kì 3 nhóm IIA
Cấu hình electron của Y 1s22s22p63s23p1 ,Y ở chu kì 3 nhóm IIIA
Bài 19: Nguyên tố M thuộc phân nhóm IIA, 6g M tác dụng hết với nước thu được 6,16 lít khí H2 đo ở 27,3oC,1 atm, M là nguyên tố nào sau đây
A. Be B. Mg C. Ca D. Ba
Chọn đáp án: B
Giải thích:
M + 2H2O ⟶ M(OH)2 + H2
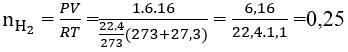
Theo phương trình phản ứng
M + 2H2O ⟶ M(OH)2 + H2
1 mol 1 mol
0,25 mol 0,25 mol
Khối lượng mol của M = 6/0,25 = 24. M là Mg
Bài 20: Một hợp chất ion có công thức XY. Hai nguyên tố X,Y thuộc 2 chu kì kế cận nhau trong bảng tuần hoàn. X thuộc nhóm IA hoặc IIA, còn Y thuộc VIA hoặc VIIA. Biết tổng số electron trong XY bằng 20. XY là hợp chất nào sau đây
A. NaCl B. NaF C. MgO D. B và C đúng
Chọn đáp án: D
Giải thích:
X thuộc nhóm IA,IIA nên có điện hóa trị +1,+2
Y thuộc cùng nhóm VIA,VIIA nên Y có điện hóa trị -2 và -1
Ngoài ra ZX + ZY = 20. Vì X, Y thuộc hai chu kì kế cận nên nghiệm thích hợp là
ZX = 11 thì ZY= 9 ; X là Na , Y là F và XY là NaF
ZX = 12 thì ZY =8 ; X là Mg , Y là O và XY là MgO
Bài 21: Oxit cao nhất của một nguyên tố ứng với công thức R2O5. Hợp chất của nó với hidro là một chất có thành phần không đổi với R chiếm 82,35% và H chiếm 17,65% về khối lượng. Tìm nguyên tố R.
A. N B. As C. P D. Cl
Chọn đáp án: A
Giải thích:
Nguyên tố có oxit cao nhất là R2O5 → R thuộc nhóm VA.
→ Hợp chất với hidro: RH3
![]() → MR = 14. Đó là nguyên tố N.
→ MR = 14. Đó là nguyên tố N.
Bài 22: Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng thái cơ bản) là 2p6. Tổng số hạt mang điện trong nguyên tử R là
A. 10 B. 11 C. 22 D. 23
Chọn đáp án: C
Giải thích:
Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng thái cơ bản) là 2p6
→ Cấu hình electron của R là 1s22s22p63s1
→ R có p = e =11
→ tổng số hạt mang điện trong nguyên tử R là : p+e = 11+11 = 22
Bài 23: Hòa tan hết a gam oxit kim loại M (thuộc nhóm IIA) bằng một lượng vừa đủ dung dịch H2SO4 17,5% thu được dung dịch muối có nồng độ 20%. Xác định công thức oxit kim loại M
A. MgO B. FeO C. CaO D. BaO
Chọn đáp án: A
Giải thích:
Gọi số mol oxit MO = x mol.
MO + H2SO4 → MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu = (98.x.100)/17,5 = 560x (gam).
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x.
Theo bài: C% (MSO4) = 20% nên:![]()
Từ đây tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO
Bài 24: A, B là 2 kim loại nằm ở 2 chu kỳ liên tiếp thuộc nhóm IIA. Cho 4,4 gam một hỗn hợp gồm A và B tác dụng với dung dịch HCl 1M (dư) thu được 3,36 lít khí (đktc). Hai kim loại đó là
A. Mg và Ca B. Ca và Ba C. Mg và Ba D. Be và Sr
Chọn đáp án: A
Giải thích:
Gọi công thức chung của hai kim loại là M = a mol.
M + 2HCl → MCl2 + H2↑
(mol): a 2a a
Số mol H2 = 0,15 mol nên a = 0,15 mol.
Ta có: Ma = 4,4 → M = 29,33.
A và B là 2 kim loại nằm ở 2 chu kỳ liên tiếp thuộc nhóm IIA nên A là Mg và B là Ca
Bài 25: Nguyên tố R ở chu kì 3, nhóm VA trong bảng tuần hoàn. Không sử dụng bảng tuần hoàn, hãy cho biết: Trong oxit cao nhất của R thì R chiếm 43,66% khối lượng. Tính số lượng mỗi loại hạt của nguyên tử R
A. nơtron 16; electron 15; proton 14
B. nơtron 15; electron 15; proton 15
C. nơtron 16; electron 14; proton 14
D. nơtron 16; electron 15; proton 15
Chọn đáp án: D
Giải thích:
R thuộc nhóm V nên hóa trị cao nhất của R trong oxit là V. Công thức oxit là R2O5.
Theo bài: %R = 43,66% nên ![]() → R = 31 (photpho).
→ R = 31 (photpho).
Tổng số hạt electron = tổng số hạt proton = 15 (dựa vào cấu hình electron).
Tổng số hạt nơtron = 31 -15 = 16
Bài 26: Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32.Cấu hình electron của X và Y
A. X: 1s22s22p63s23p4 và Y: 1s22s22p4
B. X: 1s22s22p63s23p3 và Y: 1s22s22p4
C. X: 1s22s22p63s23p6 và Y: 1s22s22p4
D. X: 1s22s22p63s23p4 và Y: 1s22s22p6
Chọn đáp án: A
Giải thích:
Gọi số hạt prroton, nơtron, electron của nguyên tử X là P, N, E và của Y là P’, N’, E’.
Theo bài: P = N = E và P’ = N’ = E’.
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
![]()
Tổng số proton trong phân tử XY2 là 32 nên P + 2P’ = 32.
Từ đây tìm được: P = 16 (S) và P’ = 8 (O).
Hợp chất cần tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4
Bài 27: X và Y là hai nguyên tố thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn, ở trạng thái đơn chất X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y 23. Biết rằng X đứng sau Y trong bảng tuần hoàn. X là
A. O B. Mg C. S D. P
Chọn đáp án: D
Giải thích:
Vì pX + pY = 23 nên X và Y là những nguyên tố thuộc chu kì nhỏ
X và Y là 2 nguyên tố thuộc 2 nhóm kế tiếp
→ số proton của X và Y hơn kém nhau 1 hoặc 7 hoặc 9
Ta xét từng trường hợp
Nếu px-py = 1 → pX =12 (Mg), pY =11 (Na)
ở trạng thái đơn chất hai nguyên tố này không phản ứng với nhau (loại)
Nếu pX- pY =7 → pX =15 (P), pY =8(O)
ở trạng thái đơn chất hai nguyên tố phản ứng được với nhau (nhận)
Nếu pX- pY =9 → pX =16 (S), pY =7(N)
ở trạng thái đơn chất hai nguyên tố này không phản ứng với nhau (loại)
Vậy X là P
Bài 28: Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố X ở nhóm IIA, nguyên tố Y ở nhóm VA. Công thức của hợp chất tạo thành từ 2 nguyên tố trên có dạng là
A. X2Y3 B. X2Y5 C. X3Y2 D. X5Y2
Chọn đáp án: C
Giải thích:
Do X dễ nhường 2 electron để đạt cấu hình bền vững → X có số oxi hóa +2
Y dễ nhận 3 electron để đạt cấu hình bền vững → Y có số oxi hóa -3
→ Công thức phù hợp là X3Y2
Bài 29: Tính kim loại giảm dần trong dãy:
A. Al, B, Mg, C
B. Mg, Al, B, C
C. B, Mg, Al, C
D. Mg, B, Al, C
Chọn đáp án: B
Giải thích:
Trong cùng 1 nhóm tính kim loại tăng dần theo chiều tăng của điện tích hạt nhân do đó tính kim loại B < Al
Trong cùng 1 CK tính kim loại giảm dần theo chiều tăng của điện tích hạt nhân do đó tính kim loại B > C, Mg > Al
⇒ Tính kim loại giảm dần trong dãy : Mg, Al, B, C
Bài 30: Tính phi kim tăng dần trong dãy :
A. P, S, O, F
B. O, S, P, F
C. O, F, P, S
D. F, O, S, P
Chọn đáp án: A
Giải thích:
Trong cùng 1 nhóm tính phi kim giảm dần theo chiều tăng của điện tích hạt nhân do đó tính phi kim O>S
Trong cùng 1 CK tính phi kim tăng dần theo chiều tăng của điện tích hạt nhân do đó tính phi kim P<S; O<F
⇒ Tính phi kim tăng dần trong dãy: P, S, O, F
Bài 31: Một nguyên tố X thuộc chu kì 3 có số electron s bằng số electron p. X ở cùng nhóm với nguyên tố nào sau đây?
A. 30Q B. 38R C. 19T D. 14Y
Chọn đáp án: B
Giải thích:
Nguyên tố X ở chu kì 3 có số electron s bằng số electron p.
X có 6 electron s ⇒ có 6 electron p.
Vậy cấu hình electron của X là 1s22s22p63s2
⇒ X ở trong nhóm IIA, cùng nhóm với 38R .
Bài 32: Dãy các nguyên tố nào dưới đây được sắp xếp theo chiều tăng dần tính kim loại?
A. Li, Be, Na, K.
B. Al, Na, K, Ca.
C. Mg, K, Rb, Cs.
D. Mg, Na, Rb, Sr.
Chọn đáp án: C
Giải thích:
Trong 1 chu kì, tính kim loại giảm dần (đi từ trái qua phải).
Trong 1 nhóm, tính kim loại tăng dần (đi từ trên xuống dưới).
Do đó dãy sắp xếp tăng dần tính kim loại là: Mg, K, Rb, Cs
Bài 33: Cho 3 nguyên tố X, Y, Z lần lượt ở vị trí 11, 12, 19 của bảng tuần hoàn. Hidroxit của X, Y, Z tương ứng là X’, Y’, Z’. Thứ tự tăng dần tính bazo là:
A. X’<Y’<Z’
B. Y’<X’<Z’
C. Z’<Y’<X’
D. Z’<X’<Y’.
Chọn đáp án: B
Giải thích:
ZX = 11 có cấu hình e lớp ngoài cùng là 3s1
ZY = 11 có cấu hình e lớp ngoài cùng là 3s2
ZZ = 19 có cấu hình e lớp ngoài cùng là 4s1
Trong cùng 1 nhóm tính kim loại tăng dần theo chiều tăng của điện tích hạt nhân do đó tính bazo tương ứng của X’ < Z’
Trong cùng 1 CK tính kim loại giảm dần theo chiều tăng của điện tích hạt nhân do đó tính bazo tương ứng của X’>Y’
Bài 34: Tính bazơ tăng dần trong dãy : (3)
A. Al(OH)3; Ba(OH)2; Mg(OH)2
B. Ba(OH)2; Mg(OH)2; Al(OH)3
C. Mg(OH)2; Ba(OH)2; Al(OH)3
D. Al(OH)3; Mg(OH)2; Ba(OH)2
Chọn đáp án: D
Giải thích:
Tính bazo được xét theo tính kim loại
Trong cùng 1 nhóm tính kim loại tăng dần theo chiều tăng của điện tích hạt nhân do đó tính bazo tương ứng của Mg < Ba
Trong cùng 1 CK tính kim loại giảm dần theo chiều tăng của điện tích hạt nhân do đó tính bazo tương ứng của Al < Mg
Bài 35: Bán kính nguyên tử các nguyên tố: Na, Li, Be, B. Xếp theo chiều tăng dần là:
A. B < Be < Li < Na
B. Na < Li < Be < B
C. Li < Be < B < Na
D. Be < Li < Na < B
Chọn đáp án: A
Giải thích:
Trong cùng 1 nhóm bán kính kim loại tăng dần theo chiều tăng của điện tích hạt nhân do đó bán kính Li<Na
Trong cùng 1 CK bán kính kim loại giảm dần theo chiều tăng của điện tích hạt nhân do đó bán kính B<Be<Li
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 2: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn phần 4. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








