Trắc nghiệm chương 3: Liên kết hóa học phần 1
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 3: Liên kết hóa học phần 1 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 3
Câu 1. Nguyên tử Al có 3 electron hóa trị. Kiểu liên kết hóa học nào được hình thành khi nó liên kết với 3 nguyên tử flo:
A. Liên kết kim loại. B. Liên kết cộng hóa trị có cực.
C. Liên kết cộng hóa trị không cực. D. Liên kết ion.
Đáp án D
Câu 2. Dãy nào sau đây không chứa hợp chất ion?
A. NH4Cl, OF2, H2S. B. CO2, Cl2, CCl4
C. BF3, AlF3, CH4 . D. I2, CaO, CaCl2.
Đáp án B
Câu 3. Cho nguyên tử Liti (Z = 3) và nguyên tử Oxi (Z = 8). Nội dung nào sau đây không đúng:
A. Cấu hình e của ion Li+: 1s2 và cấu hình e của ion O2–: 1s22s22p6.
B. Những điện tích ở ion Li+và O2–do: Li → Li ++ e và O + 2e → O2– .
C. Nguyên tử khí hiếm Ne có cấu hình e giống Li +và O2–.
D. Có công thức Li2O do: mỗi nguyên tử Li nhường 1 e mà một nguyên tử O nhận 2 e.
Đáp án C
Câu 4. Cho các hợp chất: NH3, H2O, K2S, MgCl2, Na2O CH4. Chất có liên kết ion là:
A. NH3, H2O, K2S, MgCl2 B. K2S, MgCl2, Na2O, CH4
C. NH3, H2O, Na2O CH4 D. K2S, MgCl2, Na2O
Đáp án D
Câu 5. Cấu hình electron của cặp nguyên tử nào sau đây có thể tạo liên kết ion:
A. 1s22s22p3và 1s22s22p5 B.1s22s1và 1s22s22p5
C. 1s22s1và 1s22s22p63s23p2 D.1s22s22p1và 1s22s22p63s23p6
Đáp án B
Câu 6. Các nguyên tử liên kết với nhau để:
A.Tạo thành chất khí B.Tạo thành mạng tinh thể
C.Tạo thành hợp chất D. Đạt cơ cấu bền của nguyên tử
Đáp án B
Câu 7. Cho 3 ion: Na,+, Mg2+, F–. Tìm câu khẳng định sai .
A. 3 ion trên có cấu hình electron giống nhau .
B. 3 ion trên có số nơtron khác nhau.
C. 3 ion trên có số electron bằng nhau
D. 3 ion trên có số proton bằng nhau.
Đáp án D
Câu 8. Trong dãy oxit sau: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7. Những oxit có liên kết ion là:
A. Na2O, SiO2, P2O5. B. MgO, Al2O3, P2O5
C. Na2O, MgO, Al2O3. D. SO3, Cl2O3, Na2O.
Đáp án C
Câu 9. Nguyên tử oxi có cấu hình electron là: 1s22s22p4. Sau khi tạo liên kết, nó có cấu hình là:
A. 1s22s22p2 B.1s22s22p43s2.
C. 1s22s22p6. D. 1s22s22p63s2.
Đáp án C
Câu 10. Ion nào sau đây có 32 electron:
A. CO32- B. SO42- C. NH4+ D. NO3-
Đáp án A
Câu 11. Chọn câu đúng nhất về liên kết cộng hóa trị
Liên kết cộng hóa trị là liên kết:
A. Giữa các phi kim với nhau.
B. Trong đó cặp electron chung bị lệch về một nguyên tử.
C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
D. Được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
Đáp án D
Câu 12: Các chất mà phân tử không phân cực là
A. H2O, CO2, CH4
B. O2, CO2, C2H2
C. NH3, Cl2, C2H4
D. HBr, C2H6, I2
Đáp án B
Câu 13: Cấu hình electron lớp ngoài cùng của nguyên tử Cl (Z=17), Ca (Z=20) và liên kết giữa canxi và clo trong hợp chất CaCl2 lần lượt là
A. 3s23p5, 4s1và liên kết cộng hóa trị
B. 3s23p3, 4s2và liên kết ion
C. 3s23p5, 4s2và liên kết ion
D. 3s23p3, 4s1và liên kết cộng hóa trị
Đáp án C
Câu 14. Chọn câu đúng trong các câu sau:
A. Trong liên kết cộng hóa trị, cặp electron lệch về phía nguyên tử có độ âm điện nhỏ hơn.
B. Liên kết cộng hóa trị có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
C. Liên kết cộng hóa trị không có cực được tạo nên từ các nguyên tử khác hẳn nhauvề tính chất hóa học.
D. Hiệu độ âm điện giữa 2 nguyên tử lớn thì phân tử phân cực yếu.
Đáp án B
Câu 15. Độ âm điện của một nguyên tử đặc trưng cho:
A. Khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
B. Khả năng nhường electron của nguyên tử đó cho nguyên tử khác.
C. Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
D. Khả năng nhường proton của nguyên tử đó cho nguyên tử khác.
Đáp án A
Câu 16. Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nào trong các chất sau đây: AlCl3, CaCl2, CaS, Al2S3?
(HD Hiệu độ âm điện CaCl2: 2, 16 -> Liên kết ion.
Hiệu độ âm điện AlCl3, CaS, Al2S3lần lượt là: 1,55; 1,58; 0,97 ⇒ Liên kết cộng hóa trị có cực)
Câu 17. Số OXH của cacbon và oxi trong phân tử CO2 là:
A. 4 và 2 B. 4 và -2 C. +4 và -2 D. 3 và 2
Đáp án C
Câu18: Liên kết cộng hóa trị tồn tại nhờ:
A. Các đám mây electron. B. Các electron hoá trị.
C. Các cặp electron dùng chung. D. Lực hút tĩnh điện.
Đáp án C
Câu 19: Liên kết cộng hóa trị là liên kết:
A. Hình thành do sự góp chung một electron.
B. Hình thành do sự góp chung các electron.
C. Hình thành do sự góp chung 2 electron.
D. Hình thành do sự góp chung các cặp electron.
Đáp án B
Câu 20. Trong phân tử nitơ, các nguyên tử liên kết với nhau bằng liên kết:
A. Cộng hóa trị không có cực. B. Ion yếu.
C. Ion mạnh. D. Cộng hóa trị phân cực.
Đáp án A
Câu 21. Liên kết trong phân tử HCl là liên kết:
A. Cộng hóa trị phân cực. B. Cộng hóa trị không phân cực.
C. Cho – nhận. D. Ion.
Đáp án A
Câu 22. Liên kết trong phân tử NaCl là liên kết:
A. Cộng hóa trị phân cực. B. Cộng hóa trị không phân cực.
C. Cho – nhận. D. Ion.
Câu 23. Trong các hợp chất sau đây, hợp chất nào có liên kết cộng hóa trị:
A. LiCl. B. NaF. C. CaF2. D. CCl4.
Đáp án D
Câu 24. Trong các hợp chất sau đây, hợp chất nào có liên kết ion:
A. HCl. B. H2O. C. NH3. D. NaCl.
Đáp án D
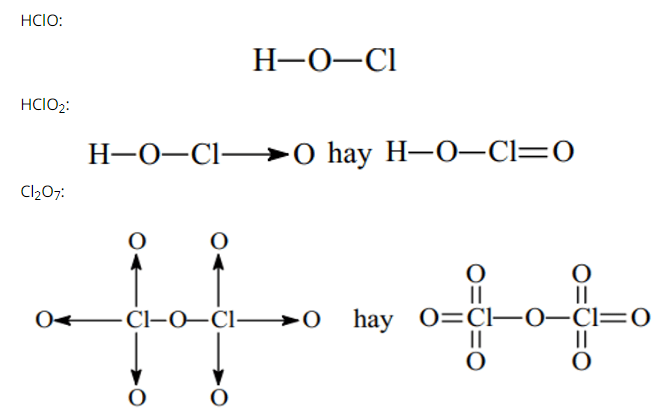
Câu 25. Viết công thức cấu tạo của các chất sau: HClO, HClO2 , Cl2O7.
Câu 26: Viết công thức cấu tạo các phân tử SO2; SO3; H2SO4.
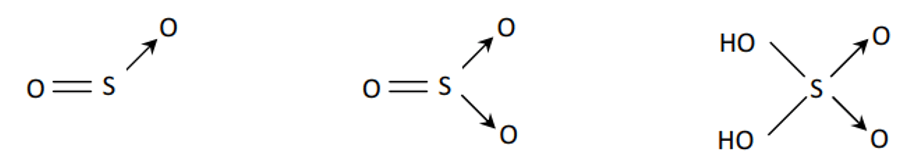
Câu 27. Số oxi hóa của Fe trong Fe3+, S trong SO3 , P trong PO43-lần lượt là:
A. 0, +3, +6, +5
B. 0, +3, +5, +6
C. +3, +5, 0, +6
D. +5, +6, +3, 0
Đáp án B
Câu 28: Trong phân tử NaCl, điện hóa trị của Na và Cl lần lượt là
A. +1 và -1 C. -1 và -1
B. +1 và +1 D. -1 và +1
Đáp án A
Câu 29: Nguyên tố R là phi kim thuộc nhóm A. Hợp chất của R với hidro là RH3. Hóa trị với số oxi hóa của R trong oxit tương úng với hóa trị cao nhất lần lượt là
A. 3 và -3 B. 5 và -5
C. 5 và +5 D. 3 và +3
Đáp án C
Câu 30: Nguyên tố R có cấu hình electron lớp ngoài cùng là ns2np4. Công thức hợp chất của R với H và công thức oxit tương ứng với hóa trị cao nhất của R lần lượt là
A. RH2 và RO
B. RH2 và RO2
C. RH4 và RO2
D. RH2 và RO3
Đáp án D
Câu 31: Hóa trị với số oxi hóa của N trong phân tử HNO3 lần lượt là
A. 3 và -3 B. 5 và -5
C. 4 và +5 D. 3 và +3
Đáp án C
Câu 32: Cho một số hợp chất: H2S, H2SO3, H2SO4, NaHS, Na2SO3, SO3, K2S, SO2. Dãy các chất trong đó lưu huỳnh có cùng số oxi hóa là
A. H2S, H2SO3, H2SO4
B. H2SO3, H2SO4, Na2SO3, SO3
C. H2SO3, H2SO4, Na2SO3, SO2
D. H2S, NaHS, K2S
Đáp án D
Câu 33. Dãy các chất nào dưới đây được sắp xếp theo chiều tăng dần số oxi hóa của nitơ?
A. NO, N2O, NH3, NO3¯
B. NH4+, N2, N2O, NO, NO2, NO3¯
C. NH3, N2, NO2, NO, NO3¯
D. NH3, NO, N2O, NO2, N2O5
Đáp án B
Câu 34. Một hợp chất có công thức XY2 trong đó Y chiếm 50% về khối lượng. Trong hạt nhân của X có n = p và hạt nhân Y có n’ = p’. Tổng số proton trong phân tử XY2là 32. Cấu hình electron của X và Y và liên kết trong phân tử XY2 là
A. 3s23p4, 2s22p4và liên kết cộng hóa trị
B. 3s2, 2s22p5và liên kết ion
C. 3s23p5, 4s2và liên kết ion
D. 3s23p3, 2s22p3và liên kết cộng hóa trị
Đáp án A
(HD: MX = 2 MY
⇒ nX + pY = 2nY + 2pY (1)
nX = pX ; 2nY = 2pY (2)
pX + 2pY =32 (3)
Từ (1), (2) và (3) ⇒ pX =16 (S) , pY =8 (O) ⇒ SO2 liên kết cộng hóa trị
Câu 35. Nhóm hợp chất nào sau đây có liên kết cho – nhận?
A. NaCl, CO2. B. HCl, MgCl2.
C. H2S, HCl. D. NH4NO3, HNO3.
Đáp án D
Câu 36. Hình dạng của phân tử CH4, H2O, BF3 và BeH3 tương ứng là:
A. Tứ diện, gấp khúc, tam giác, thẳng.
B. Tứ diện, tam giác, gấp khúc, thẳng.
C. Tứ diện, thẳng, gấp khúc, tam giác.
D. Tứ diện, thẳng, tam giác, gấp khúc.
Đáp án A
Câu 37. Trong công thức CS2, tổng số các đôi electron tự do chưa tham gia liên kết là:
A. 2 B. 3 C. 4 D. 5
Đáp án C
Câu 38. Biết rằng tính phi kim giảm dần theo thứ tự F, O, Cl .Trong các phân tử sau, phân tử có liên kết phân cực nhất là:
A. F2O B. Cl2O C. ClF D. O2
Đáp án C
Câu 39: Nước có nhiệt độ sôi cao hơn các chất khác có công thức H2X (X là phi kim) là do
A. trong nước tồn tại ion H3O+.
B. phân tử nước có liên kết cộng hóa trị.
C. oxi có độ âm điện lớn hơn X.
D. trong nước có liên kết hiđro.
Đáp án D
Câu 40. Trong tinh thể nước đá, ở các nút của mạng tinh thể là:
A. Nguyên tử hiđro và oxi. B. Phân tử nước.
C. Các ion H+ và O2-. D. Các ion H+ và OH-.
Đáp án B
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 3: Liên kết hóa học phần 1. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








