Bảng tuần hoàn các nguyên tố hóa học lớp 10
Bảng tuần hoàn các nguyên tố hóa học
Bảng tuần hoàn các nguyên tố hóa học lớp 10 được VnDoc biên soạn là nội dung trọng tâm kiến thức bài học bảng tuần hoàn các nguyên tố hóa học lớp 10. Cũng như giúp bạn đọc biết cách xem Bảng tuần hoàn nguyên tố hóa học, biết cấu tạo cũng như sự sắp xếp các nguyên tố hóa học như thế nào.
Hy vọng qua tài liệu sẽ giúp các bạn nắm chắc kiến thức từu đó vận dụng vào giải các bài tập. Mời các bạn tham khảo
Bảng tuần hoàn nguyên tố hóa học
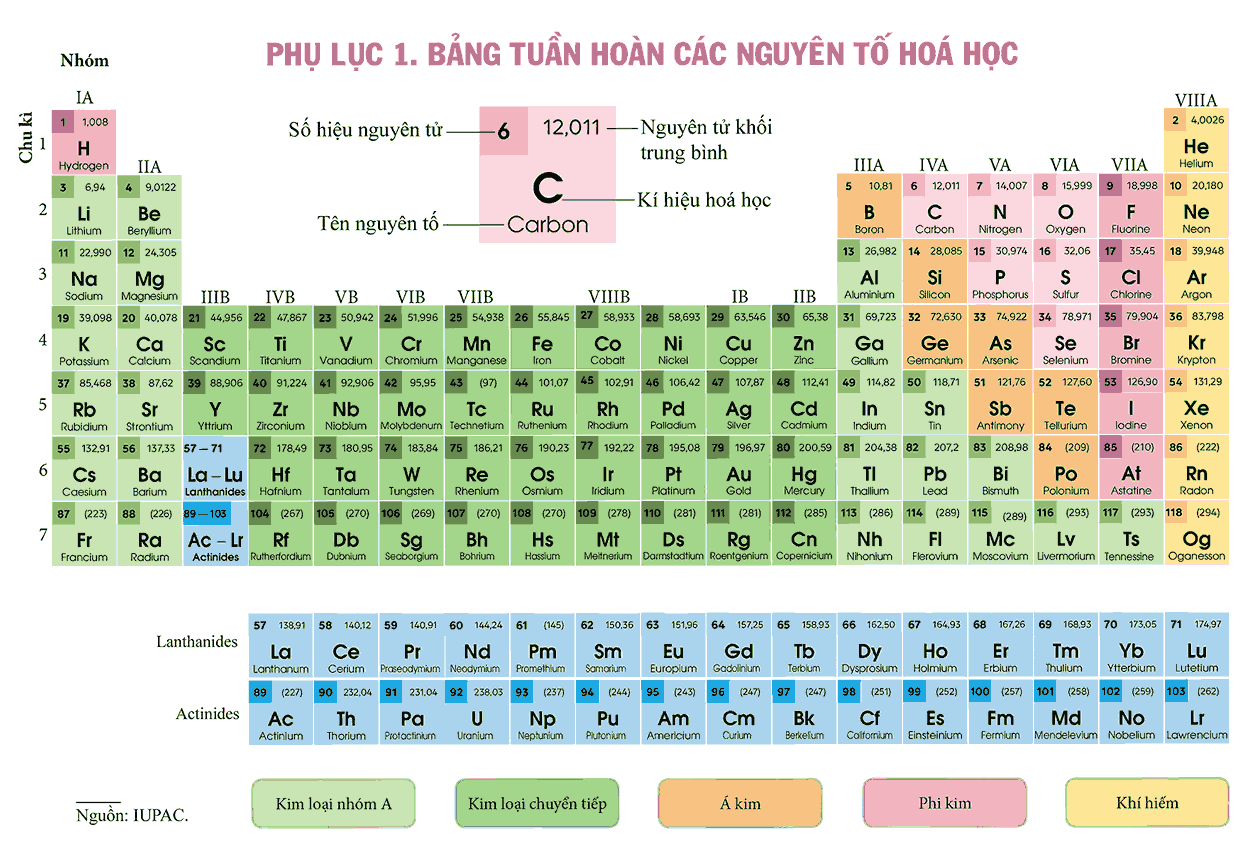
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp xếp thành một hàng (chu kì)
- Các nguyên tố có số electron hóa trị trong nguyên tử như nhau được xếp thành một cột (nhóm)
II. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
1. Ô nguyên tố
Mỗi nguyên tố hóa học được xếp vào một ô của bảng gọi là ô nguyên tố.
Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.

2. Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Chu kì 1: gồm 2 nguyên tố H (Z=1) đến He (Z=2).
Chu kì 2: gồm 8 nguyên tố Li (Z=3) đến Ne (Z=10).
Chu kì 3: gồm 8 nguyên tố Na (Z=11) đến Ar (Z=18).
Chu kì 4: gồm 18 nguyên tố K (Z=19) đến Kr (Z=36).
Chu kì 5: gồm 18 nguyên tố Rb (Z=37) đến Xe (Z=54).
Chu kì 6: gồm 32 nguyên tố Cs (Z=55) đến Rn (Z=86).
Chu kì 7: Bắt đầu từ nguyên tố Fr (Z=87) đến nguyên tố có Z = 110, đây là một chu kì chưa hoàn thành.
Chu kì 1, 2, 3: là các chu kì nhỏ.
Chu kì 4, 5, 6, 7: là các chu kì lớn.
3. Nhóm nguyên tố
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B
- Nguyên tử các nguyên tố trong cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIII)
Nhóm A: bao gồm các nguyên tố s và p.
Nhóm A gồm 8 nhóm từ IA đến VIIIA
Các nguyên tố nhóm A gồm nguyên tố s và nguyên tố p
Số thứ tự nhóm A = tổng số e lớp ngoài cùng
Nhóm B: bao gồm các nguyên tố d và f có cấu hình e nguyên tử tận cùng (n-1)dxnsy
Nếu (x+y) = 3 => 7 thì nguyên tố thuộc nhóm (x+y)B.
Nếu (x+y) = 8 => 10 nguyên tố thuộc nhóm VIIIB
Nếu (x+y) > 10 thì nguyên tố thuộc nhóm (x+y-10)B
Các nguyên tố nhóm B là tập hợp các nguyên tố có electron hóa trị nằm trên phân lớp d và f
4. Phân loại nguyên tố
a) Theo cấu hình electron
- Các nguyên tố s, p, d, f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s, p, d, f tương ứng.
Ví dụ: 12Mg: 1s22s22p63s2 (nguyên tố s)
- Các nhóm A: gồm các nguyên tố s (IA, IIA) và các nguyên tố p (từ IIIA đến VIIIA, trừ He).
- Các nhóm B: gồm các nguyên tố d (từ IB đến VIIIB) và các nguyên tố f (lanthanides và actinides).
b) Theo tính chất hóa học
- Các nhóm IA, IIA, IIIA: gồm các nguyên tố s, p là kim loại (trừ H, B).
- Các nhóm VA, VIA, VIIA: gồm các nguyên tố p, thường là phi kim.
- Nhóm VIIIA: gồm các nguyên tố khí hiếm.
- Các nhóm B: gồm các nguyên tố d và f đều là kim loại chuyển tiếp.
..............................









