Trắc nghiệm chương 1: Nguyên tử phần 3
Chuyên đề Hóa học lớp 10: Trắc nghiệm chương 1: Nguyên tử phần 3 được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Bài tập trắc nghiệm chương 1
Bài 1: Nguyên tử nguyên tố X có Z = 17. Số electron thuộc lớp ngoài cùng của X là giá trị Nào dưới đây?
A. 1. B. 2. C. 7. D. 3.
Chọn đáp án: C.
Giải thích: Cấu hình electron của X: 1s22s22p63s23p5
Bài 2: Số lớp electron của lớp Mg (Z = 12) là:
A. 2 B. 4 C. 8 D. 3
Chọn đáp án: D.
Giải thích: Cấu hình e của Mg: 1s22s22p63s2
Bài 3: Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
A. Lớp K B. Lớp M C. Lớp N D. Lớp L
Chọn đáp án: A.
Giải thích: Lớp K gần hạt nhân nhất, liên kết chặt chẽ nhất với hạt nhân.
Bài 4: Tổng số hạt (n, p, e) trong ion![]() là
là
A. 52. B. 53. C. 35. D. 51.
Chọn đáp án: B.
Giải thích:
Số hạt p = 17, e = 18 (do Clo đã nhận thêm 1e tạo ion Cl-), n = A – P = 35-17 = 18.
Tổng số hạt: p + n + e = 53.
Bài 5: Số p, n, e của ion![]() lần lượt là
lần lượt là
A. 24, 28, 24.
B. 24, 30, 21.
C. 24, 28, 21.
D. 24, 28, 27.
Chọn đáp án: C.
Giải thích: Số hạt p = 24, e = 21 (do Cr đã nhường đi 3e tạo ion Cr3+), n = A – P = 52-24 = 28.
Bài 6: Trong dãy kí hiệu các nguyên tử sau, dãy nào chỉ cùng một nguyên tố hóa học:
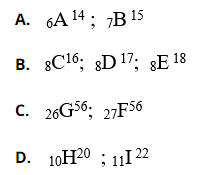
Chọn đáp án: B.
Giải thích: Nguyên tố hóa học là những nguyên tử có cùng số hạt proton.
Bài 7: Kí hiệu ntử![]() cho ta biết những gì về nguyên tử X?
cho ta biết những gì về nguyên tử X?
A. Số hiệu nguyên tử và số khối
B. Chỉ biết nguyên tử khối trung bình của nguyên tử
C. Số hiệu nguyên tử
D. Số khối
Chọn đáp án: A.
Bài 8: Người ta kí hiệu nguyên tử của một nguyên tố hoá học như sau: ![]() trong đó A là tổng số hạt proton và nơtron, Z là số hạt proton. Những nguyên tử thuộc cùng một nguyên tố hóa học là
trong đó A là tổng số hạt proton và nơtron, Z là số hạt proton. Những nguyên tử thuộc cùng một nguyên tố hóa học là
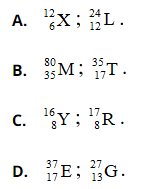
Chọn đáp án: C.
Giải thích: Nguyên tố hóa học là những nguyên tử có cùng số hạt proton.
Bài 9: Các ion ![]() bằng nhau về:
bằng nhau về:
A. số khối B. số electron C. số proton D. số nơtron
Chọn đáp án: B.
Giải thích:

Bài 10: Electron được phát minh năm 1897 bởi nhà bác học người Anh Tom-xơn.Từ khi đc phát hiện đến nay ,electron đó đóng vai trò to lớn trong nhiều lĩnh vực của cuộc sống như: Năng lượng ,truyền thông và thông tin...Trong các câu sau đây câu nào sai?
A. Electron có khối lượng không đáng kể so với khối lượng nguyên tử.
B. Electron chỉ thoát ra khỏi nguyên tử trong những điều kiện đặc biệt.
C. Electron có khối lượng bằng 9,1095.10-28 gam
D. Electron là hạt mang điện tích âm.
Chọn đáp án: C
Giải thích: Khối lượng của electron = 9,1.10-31 kg.
Bài 11: Nguyên tử nào trong các ntử sau đây chứa 8 prontron, 8 notron và 8 electron?
A. 17O B. 18O C. 16O D. 17F
Chọn đáp án: C
Giải thích: A = Z + N = 8 + 8 = 16
Bài 12: Chọn câu đúng khi nói về nguyên tử![]() trong các câu sau:
trong các câu sau:
A. Mg có 12 electron
B. Mg có 24 proton
C. Mg có 24 electron
D. Mg có 24 nơtron
Chọn đáp án: A
Giải thích: Nguyên tử Mg có p = e = n = 12, số khối A = 24.
Bài 13: Tìm câu sai trong các câu sau:
A. Trong nguyên tử hạt electron mang điện âm.
B. Trong nguyên tử, hạt nhân mang điện dương.
C. Trong nguyên tử, hạt nơtron mang điện dương.
D. Trong nguyên tử, hạt nơtron không mang điện.
Chọn đáp án: C
Giải thích: Nơtron là hạt không mang điện.
Bài 14: Trong thành phần của mọi nguyên tử nhất thiết phải có các loại hạt nào sau đây?
A. Proton và nơtron
B. Proton và electron
C. Nơtron và electron
D. Proton, nơtron, electron
Chọn đáp án: B.
Giải thích: Nguyên tử hiđro không có hạt nơtron.
Bài 15: Trong tự nhiên cacbon có 2 đồng vị bền là![]() . Nguyên tử khối trung bình của cacbon là 12,011. Phần trăm của 2 đồng vị trên lần lượt là
. Nguyên tử khối trung bình của cacbon là 12,011. Phần trăm của 2 đồng vị trên lần lượt là
A. 98,9% và 1,1%
B. 49,5% và 51,5%
C. 99,8% và 0,2%
D. 75% và 25%
Chọn đáp án: A.
Giải thích: Gọi % của đồng vị![]() là x, thì % của đồng vị
là x, thì % của đồng vị![]() là 100 - x
là 100 - x
Ta có
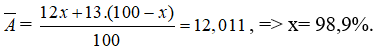
Bài 16: Nguyên tử khối trung bình của nguyên tố R là 79,91. Trong tự nhiên R có 2 đồng vị bền. Biết đồng vị![]() chiếm 54,5%. Số khối của đồng vị thứ hai là
chiếm 54,5%. Số khối của đồng vị thứ hai là
A. 80 B. 81 C. 82 D. 83
Chọn đáp án: B.
Giải thích:
Gọi số khối của đồng vị thứ 2 là x
Đồng vị ![]() chiếm 54,5%, vậy đồng vị còn lại chiếm 100 – 54,5 =45,5%
chiếm 54,5%, vậy đồng vị còn lại chiếm 100 – 54,5 =45,5%
Ta có![]() , vậy x = 81
, vậy x = 81
Bài 17: Hiđro có 3 đồng vị là![]() . Be có 1 đồng vị là 9Be. Có bao nhiêu loại phân tử BeH2 cấu tạo từ các đồng vị trên?
. Be có 1 đồng vị là 9Be. Có bao nhiêu loại phân tử BeH2 cấu tạo từ các đồng vị trên?
A. 1 B. 6 C. 12 D. 18
Chọn đáp án: B.
Giải thích: Các phân tử BeH2 lần lượt là: Be1H1H
Be2H2H Be3H3
Be1H2H Be2H3H Be1H3H
Bài 18: Trong các phát biểu sau, phát biểu nào là đúng?
A. Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về số nơtron.
B. Đồng vị là những nguyên tố có cùng vị trí trong bảng tuần hoàn.
C. Đồng vị là những nguyên tử có cùng số hạt nơtron.
D. Đồng vị là những nguyên tố có cùng điện tích hạt nhân nhưng khác nhau về số nơtron.
Chọn đáp án: A.
Bài 19: Electron cuối cùng của nguyên tử nguyên tố X được phân bổ vào phân lớp 3d6. X là
A. Zn B. Fe C. Ni; D. S
Chọn đáp án: B.
Giải thích: Cấu hình đầy đủ của X là:
1s22s22sp63s23p63d64s2 e = p =26 (Fe).
Bài 20: Nguyên tử của nguyên tố nhôm có 13 electron. Kết luận nào sau đây đúng?
A. Phân lớp electron ngoài cùng của nhôm có 3e.
B. Lớp electron ngoài cùng của nhôm có 1e.
C. Lớp L (lớp thứ 2) của nhôm có 6e.
D. Lớp electron ngoài cùng của nhôm có 3e.
Chọn đáp án: D.
Giải thích: Cấu hình của Al: 1s22s22sp63s23p1.
Bài 21: Câu nào dưới đây là đúng nhất?
A. Tất cả các nguyên tố mà nguyên tử có 3 electron ở lớp ngoài cùng đều là kim loại hoạt động mạnh.
B. Các nguyên tố mà nguyên tử có 5 electron ở lớp ngoài cùng thường là phi kim.
C. Tất cả các nguyên tố mà nguyên tử có 4 electron ở lớp ngoài cùng đều là phi kim.
D. Tất cả các nguyên tố mà nguyên tử có 8 electron ở lớp ngoài cùng đều là kim loại.
Chọn đáp án: B.
Giải thích:
Các nguyên tố mà nguyên tử có 4 electron ở lớp ngoài cùng có thể là kim loại hoặc phi kim.
Các nguyên tố mà nguyên tử có 8 electron ở lớp ngoài cùng là khí hiếm.
Các nguyên tố mà nguyên tử có 3 electron ở lớp ngoài cùng đều là kim loại hoạt động trung bình.
Bài 22: Số hiệu nguyên tử của các nguyên tố cho biết
A. số electron hoá trị và số nơtron.
B. số proton trong hạt nhân và số nơtron.
C. số electron trong nguyên tử và số khối.
D. số electron và số proton trong nguyên tử.
Chọn đáp án: D.
Giải thích: Số hiệu nguyên tử = số hạt p = số hạt nơtron.
Bài 23: Cation X+ có cấu hình electron ở lớp vỏ ngoài cùng là 2s22p6. Cấu hình electron của phân lớp ngoài cùng của nguyên tử X là
A. 3s1. B. 3s2. C. 3p1. D. 2p5.
Chọn đáp án: A.
Giải thích: Cấu hình electron của X: 1s22s22p63s1
Bài 24: Cấu hình electron nào dưới đây là của nguyên tử nguyên tố X (Z=24)?
A. [Ar] 3d54s1
B. [Ar] 3d44s2
C. [Ar] 4s24p6
D. [Ar] 4s14p5
Chọn đáp án: A.
Giải thích: Cấu hình của Crom:
1s22s22p63s23p63d44s2 → 1s22s22p6 3s23p64s23d54s1 (cấu hình bền vững hơn)
Bài 25: Cấu hình electron nào dưới đây viết không đúng?
A. 1s22s22p63s23p64s23d6
B. 1s22s22p5
C. 1s22s22p63s1
D. 1s22s22p63s23p5
Chọn đáp án: A.
Giải thích: Cấu hình đúng: 1s22s22p63s23p63d64s2
Bài 26: Ion nào dưới đây có cấu hình electron của khí hiếm Ne?
A. Be2+ B. Cl- C. Mg2+ D. Ca2+
Chọn đáp án: C.
Giải thích: Cấu hình của Ne: 1s22s22p6
Bài 27: Cấu hình electron nào dưới đây là của ion Fe3+?
A. 1s22s22p63s23p63d5
B. 1s22s22p63s23p63d6
C. 1s22s22p63s23p63d6 4s2
D. 1s22s22p63s23p63d34s2
Chọn đáp án: A.
Bài 28: Nguyên tử nào trong số các nguyên tử sau đây có 20 proton, 20 electron, 19 nơtron?
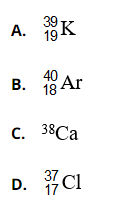
Chọn đáp án: A
Giải thích: Số khối A = Z + N = 20 + 19 = 39
Bài 29: Nguyên tử X có tổng số hạt proton, nơtron, electron là 34. Biết số nơtron nhiều hơn số proton là 1. Số khối của X là
A. 11 B. 19 C. 21 D. 23
Chọn đáp án: D
Giải thích:
Tổng số hạt proton, nơtron và electron trong nguyên tử X là 34:
P + e + n = 34 hay 2p + n = 34 (do p = e) (1)
Số hạt nơtron nhiều hơn số hạt proton 1 hạt:
n – p = 1 (2)
Giải (1), (2) ta có p = e = 11, n = 12
Số khối của X = 11 + 12 = 23
Bài 30: Nguyên tử nguyên tố X có tổng số hạt bằng 82, hạt mang điện nhiều hơn hạt không. Mang điện là 22 hạt. Số khối A của nguyờn tử X là
A. 52 B. 48 C. 56 D. 54
Chọn đáp án: C
Giải thích:
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố X là 82:
P + e + n = 82 hay 2p + n = 82 (do p = e) (1)
Số hạt mang điện (p và e) nhiều hơn số hạt không mang điện (n) là 22 hạt
(p + e) – n = 22 hay 2p – n = 22 (2)
Giải (1), (2) ta có p = e = 26; n =30
Số khối của X = Z + N = p + n =56
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Trắc nghiệm chương 1: Nguyên tử phần 3. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và giới thiệu tới các bạn đọc.








