Đồng vị - Nguyên tử khối và nguyên tử khối trung bình
Chuyên đề Hóa học lớp 10: Đồng vị - Nguyên tử khối và nguyên tử khối trung bình được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Đồng vị - Nguyên tử khối và nguyên tử khối trung bình
I. Đồng vị
Đồng vị là những nguyên tử của cùng một nguyên tố có cùng số proton, khác số nơtron.
Ví dụ: Nguyên tố H có 3 đồng vị ![]()
Chú ý: Các đồng vị bền có Z ≤ 82.
II. Nguyên tử khối & Nguyên tử khối trung bình
1/ Nguyên tử khối
a/ Nguyên tử khối (M): Nguyên tử khối là khối lượng tương đối của nguyên tử, bằng số khối hạt nhân: M = A
2/ Nguyên tử khối trung bình (M−)
Nguyên tử khối trung bình của nguyên tố có nhiều đồng vị được tính bằng hệ thức
![]()
Với: a, b, c là số nguyên tử (hoặc % số nguyên tử) của mỗi đồng vị.
A, B, C là nguyên tử khối (hay số khối) của mỗi đồng vị.
Ví dụ: Nguyên tố Cacbon có 2 đồng vị bền 126C chiếm 98,89% và 136C chiếm 1,11%. Nguyên tử khối trung bình của cacbon là:
![]()
Mở rộng:
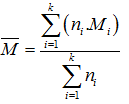
Với: ni : % hay số mol hay thể tích của chất thứ i ( khi ni là thể tích thì chỉ sử dụng cho chất khí)
Mi : Khối lượng mol của chất thứ i
Nếu trong hỗn hợp chỉ có hai chất , ta có thể gọi x là số mol (% hay thể tích) của chất thứ nhất trong 1 mol hỗn hợp, khi đó suy ra số mol của chất thứ hai là (1 – x) mol.
M− = x.M1 + (1 - x).M2
Lưu ý:
► Mmin < M− < Mmax
► 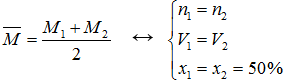 (thể tích của khí không áp dụng cho thể tích dung dịch)
(thể tích của khí không áp dụng cho thể tích dung dịch)
► M1 = M2 → M− = M1 = M2 ∀n, V, x
► M−đơn chất ↔ M−hợp chất
► Sơ đồ đường chéo:
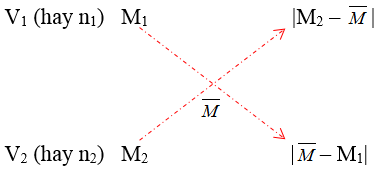
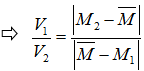
► Cần nhớ:
- Phân biệt nguyên tử và nguyên tố:
+ Nguyên tử là loại hạt vi mô gồm hạt nhân và các hạt electron quanh hạt nhân.
+ Nguyên tố là tập hợp các nguyên tử có cùng điện tích hạt nhân.
- Tính chất hóa học nguyên tố là tính chất hóa học các nguyên tử của nguyên tố đó.
- Mối quan hệ giữa các hạt cơ bản cấu tạo nên nguyên tử:
+ Số hạt mang điện = số electron + số proton = 2.Z .
+ Số hạt cơ bản = Z + E + N = 2.Z + N (mang điện: 2.Z, không mang điện: N).
+ Số hạt ở hạt nhân = số proton + số nơtron = Z + N.
+ Điều kiện bền của hạt nhân nguyên tử là ![]() với Z ≤ 20;
với Z ≤ 20; ![]() với Z ≤ 82
với Z ≤ 82
Tổng hạt = Z + E + N = 2.Z + N mà : Z ≤ N ≤ 1,5.Z
Nên: 2.Z + Z ≤ 2.Z + N ≤ 2.Z + 1,5.Z ⇒ 3.Z ≤ Tổng hạt ≤ 3,5.Z
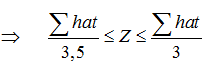
- Từ kí hiệu nguyên tử AZX ⇒ số p và số n trong hạt nhân cũng như số electron ở vỏ nguyên tử và ngược lại.
- Tất cả các nguyên tử có cùng số điện tích hạt nhân Z đều thuộc cùng một nguyên tố hóa học.
- Công thức tính thể tích của một nguyên tử:
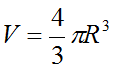 (R là bán kính nguyên tử)
(R là bán kính nguyên tử)
Trong phần chuyên đề trên đây chúng ta có thể hiểu biết thêm về Đồng vị - Nguyên tử khối và nguyên tử khối trung bình gồm các khái niệm về đồng vị, các nguyên tử khối và các công thức tính nguyên tử khối trung bình.
Trên đây VnDoc đã giới thiệu tới các bạn lý thuyết Hóa học 10: Đồng vị - Nguyên tử khối và nguyên tử khối trung bình. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Hóa học 10, Giải bài tập Hóa học lớp 10, Giải bài tập Vật Lí 10, Tài liệu học tập lớp 10 mà VnDoc tổng hợp và đăng tải.








