Cấu hình electron của nguyên tử nguyên tố Chromium
Cấu hình electron của Chromium
Cấu hình electron của nguyên tử nguyên tố Chromium được VnDoc biên soạn, tổng hợp hướng dẫn bạn học viết đúng cấu hình electron của Chromium, từ đó vận dụng làm các dạng câu hỏi bài tập có liên quan.

1. Cấu hình electron của Chromium (Z = 24)
Chromium là kim loại chuyển tiếp dãy thứ nhất, nằm ở ô số 24 trong bảng tuần hoàn hóa học
Cr (Z = 24): Thứ tự phân mức năng lượng orbital: 1s22s22p63s23p64s23d4
Do trạng thái này không bền nên 1 electron ở phân lớp 4s chuyển sang phân lớp 3d để đạt trạng thái bán bão hòa bền vững hơn.
Sau đó, sắp xếp các phân lớp theo đúng thứ tự lớp để thu được cấu hình electron của nguyên tử Cr:
Cấu hình electron của Chromium: 1s22s22p63s23p63d54s1.
Hoặc viết gọn lại: [Ar]3d54s1.
[ Ar] là kí hiệu cấu hình electron nguyên tử của nguyên tố Argon, là khí hiếm gần nhất đứng trước Cr.
2. Cấu hình electron theo orbital của chromium
Cấu hình electron của nguyên tử chromium (Z = 24) theo ô orbital là:
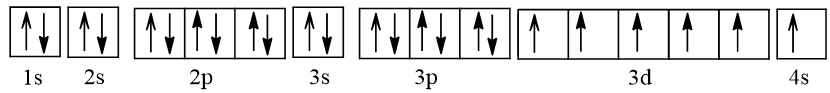
Nguyên tử Cr có 6 electron độc thân, trong đó 5 electron độc thân thuộc AO 3d, 1 electron độc thân thuộc AO 4s.
3. Vị trí, tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình electron
3.1. Vị trí Cr trong bảng tuần hoàn
Từ cấu hình electron của Cr là 1s22s22p63s23p6 3d54s1 ta xác định được:
- Cr thuộc ô số 24 (do Z = 24)
- Chu kì 4 (do có 4 lớp electron)
- Nhóm VIB (do có 6 electron hóa trị, nguyên tố d).
- Là nguyên tố d (do Cr là nguyên tố nhóm B, nguyên tử có cấu hình electron phân lớp ngoài cùng và phân lớp sát ngoài cùng là 3d54s1).
3.2. Tính chất nguyên tố
- Cr thuộc nhóm VIB nên Cr là kim loại chuyển tiếp dãy thứ nhất.
- Các mức oxi hóa đặc trưng của Cr trong hợp chất: +2, +3, +6.
4. Câu hỏi vận dụng liên quan
Câu 1. Cấu hình electron của nguyên tử nguyên tố chromium là
A. [Ar]3d44s2.
B. [Ar]4d55s1.
C. [Ar]3d54s1.
D. [Kr]3d54s1.
Cấu hình electron của nguyên tử nguyên tố chromium là [Ar]3d54s1 (Z =24).
Câu 2. Cấu hình electron của các ion Cr3+ là
A. [Ar]3d4
B. [Ar]3d2
C. [Ar]3d5
D. [Ar]3d3.
Cr → Cr3+ + 3e
[Ar]3d54s1 [Ar]3d3
Câu 3. Đặc điểm chung cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất là
A. [Ne]3d1÷104s1÷2.
B. [Ar]3d1÷104s1÷2.
C. [Ar] 3d1÷104s2.
D. [Ar] 3d104s1÷2.
Đặc điểm chung cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất là [Ar]3d1÷104s1÷2.
Câu 4. Chromium được sử dụng nhiều trong luyện kim để chế tạo hợp kim chống ăn mòn và đánh bóng bề mặt. Nguyên tử chromium có cấu hình electron viết gọn là [Ar]3d54s1. Vị trí của chromium trong bảng tuần hoàn là
A. ô số 17, chu kì 4, nhóm IA.
B. ô số 24, chu kì 4, nhóm VIB.
C. ô số 24, chu kì 3, nhóm VB
D. ô số 27, chu kì 4, nhóm IB.
Nguyên tử chromium có cấu hình electron viết gọn là [Ar]3d54s1. Suy ra:
- Số electron = vị trí của ô nguyên tố = 24.
- Có 4 lớp electron ⇒ thuộc chu kì 4.
- Có tổng số electron lớp ngoài cùng và phân lớp sát ngoài cùng là 6 ⇒ thuộn nhóm VIB.
Câu 5. Số electron độc thân có trong nguyên tử chromium là
A. 2.
B. 4.
C. 5.
D. 6.
Cấu hình electron của nguyên tử chromium (Z = 24) theo ô orbital là:

Nguyên tử Cr có 6 electron độc thân
Câu 6. Nhận định nào sau đây không đúng?
A. Chromium là kim loại chuyển tiếp thuộc chu kỳ 4 nhóm VI B, ô số 24 trong bảng tuần hoàn.
B. Chromium là nguyên tố d có cấu hình electron: [Ar] 4d54s1, có 1 electron hóa trị.
C. Khác với kim loại nhóm A, Chromium có thể tham gia liên kết bằng các electron ở cả các phân lớp 4s và 3d
D. Trong các hợp chất, Chromium có số oxi hóa hóa biến đổi từ +1 tới +6, trong đó các mức phổ biến là +2, +3, +6.
Cr có cấu hình [Ar] 4d54s1 nên có 6 electron hóa trị
------------------------------









