Ảnh hưởng của nồng độ đến tốc độ phản ứng
Ảnh hưởng của nồng độ đến tốc độ phản ứng được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Ảnh hưởng của nồng độ đến tốc độ phản ứng
Ảnh hưởng của nồng độ đến tốc độ phản ứng?
Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn.
Giải thích: Khi tăng nồng độ các chất phản ứng, dẫn đến số lượng va chạm giữa các phân tử phản ứng tăng, làm tốc độ phản ứng tăng.
Ví dụ 1: Tốc độ phản ứng giữa H2 và I2: H2(g) + I2(g) → 2HI(g) tăng lên khi tăng nồng độ của H2 và I2.
Chú ý: Khi các chất phản ứng va chạm đúng hướng và đủ năng lượng dẫn đến xảy ra phản ứng, gọi là va chạm hiệu quả.
Ví dụ 2
Thí nghiệm 1: Cho a gam Zn dạng bột tác dụng với lượng dư dung dịch HCl 1M.
Thí nghiệm 2: Cho a gam Zn dạng bột tác dụng với lượng dư dung dịch HCl 2M.
→ Ở thí nghiệm 2 phản ứng diễn ra nhanh hơn.
1. Tốc độ phản ứng
Tốc độ phản ứng của phản ứng hóa học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
Tốc độ phản ứng kí hiệu là v
Đơn vị tốc độ phản ứng là (đơn vị nồng độ) (đơn vị thời gian)-1, ví dụ: mol L-1 s-1 hay M s-1.
2. Tốc độ trung bình
Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
Cho phản ứng tổng quát: aA + bB → mM + nN.
Tốc độ phản ứng được tính dựa theo thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước sau:
![]()
Trong đó:
∆ C = C2 – C1,
∆ t = t2 – t1 lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng.
C1, C2 là nồng độ của một chất tại thời điểm t1 và t2 (với t2 > t1).
Ví dụ: Cho phản ứng phân hủy N2O5:
2N2O5(g) → 4NO2(g) + O2(g).
Tính tốc độ trung bình của phản ứng. Biết nồng độ của mỗi chất trong phản ứng trên tại thời điểm t1 = 0 và t2 = 100 s như sau:
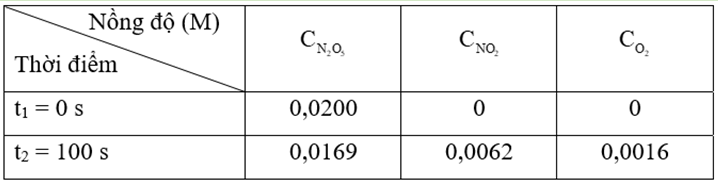
Hướng dẫn trả lời
Tính theo N2O5
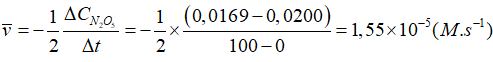
3. Các yếu tố ảnh hưởng đến tốc độ phản ứng
3.1. Ảnh hường của nồng độ
Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn.
Giải thích: Khi tăng nồng độ các chất phản ứng, dẫn đến số lượng va chạm giữa các phân tử phản ứng tăng, làm tốc độ phản ứng tăng.
3.2. Ảnh hưởng của áp suất
Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng càng lớn.
Giải thích: Đối với các chất khí, nồng độ của chất khí tỉ lệ với áp suất của nó. Do vậy, khi áp suất chất tham gia phản ứng ở thể khí tăng lên, sẽ làm nồng độ chất khí tăng lên, từ đó làm tăng tốc độ phản ứng.
Ví dụ: Xét phản ứng sau được thực hiện ở nhiệt độ 302oC: 2HI(g) → H2(g) + I2(g).
Khi áp suất của HI là 1 atm, tốc độ phản ứng đo được là 1,22.10-8 M s-1.
Khi áp suất của HI là 2 atm, tốc độ phản ứng là 4,88.10-8 M s-1.
3.3 Ảnh hưởng của diện tích bề mặt
Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn.
Ví dụ: Đá vôi (CaCO3) ở dạng bột có tổng diện tích bề mặt tiếp xúc với chất phản ứng HCl lớn hơn so với đá vôi (CaCO3) dạng viên cùng khối lượng, nên có tốc độ phản ứng lớn hơn.
3.4. Ảnh hưởng của nhiệt độ
Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng lên 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị γ = 2 – 4 này gọi là hệ số nhiệt độ Van’t Hoff.
Mối liên hệ của hệ số Van’t Hoff với tốc độ và nhiệt độ như sau:
![]()
Trong đó, v2 và v1 là tốc độ phản ứng ở nhiệt độ T2 và T1 tương ứng.
γ là hệ số nhiệt độ Van’t Hoff.
Ví dụ: Với phản ứng có γ = 2, nếu nhiệt độ tăng từ 20oC lên 60oC thì:
![]()
→ Tốc độ phản ứng tăng lên 16 lần.
3.5. Ảnh hưởng của chất xúc tác
Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị thay đổi cả về lượng và chất sau phản ứng.
Ví dụ: Dung dịch H2O2 3% ở điều kiện bình thường phân hủy rất chậm theo phương trình: 2H2O2(aq) → O2(g) + 2H2O(l).
Tuy nhiên, tốc độ phản ứng phân hủy này sẽ nhanh hơn rất nhiều khi có mặt chất xúc tác MnO2. Khi kết thúc thí nghiệm trên, màu đen của MnO2 ban đầu vẫn giữ nguyên vì MnO2 không bị biến đổi sau phản ứng phân hủy H2O2.
Các dạng câu hỏi bài luyện tập tại: Chuyên đề Bài tập Hóa 10 Tốc độ phản ứng Có đáp án
----------------------------------------









