Phương trình phản ứng Fe + S
VnDoc xin giới thiệu bài Phương trình phản ứng Fe + S được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Phương trình hóa học: Fe + S → FeS
Phương trình hóa học: Fe + S → FeS
Điều kiện phản ứng: Nhiệt độ cao
Hiện tượng nhận biết: Khi đốt nóng hỗn hợp, lưu huỳnh nóng chảy, hỗn hợp cháy sáng và bắt đầu chuyển thành hợp chất màu đen, phản ứng tỏa nhiều nhiệt.
I. Vị trí của Sắt trong bảng HTTH
– Cấu hình e nguyên tử của sắt: 1s22s22p63s23p63d64s2.
– Vị trí: Fe thuộc ô 26, chu kì 4, nhóm VIIIB.
– Cấu hình e của các ion được tạo thành từ Fe:
Fe2+: 1s22s22p63s23p63d6
Fe3+: 1s22s22p63s23p63d5
II. Tính chất vật lý của Sắt
Sắt (Fe) có nguyên tử khối bằng 56 đvC, có những tính chất vật lý sau:
– Sắt là kim loại nặng, có màu trắng xám và ánh kim
– Sắt có tính dẻo, dẫn nhiệt, dẫn điện tốt nhưng kém hơn Sắt
– Sắt có tính nhiễm từ
– Khối lượng riêng: 7,86 g/cm3
– Nhiệt độ nóng chảy: 1539°C
III. Tính chất hóa học
Sắt có những tính chất của kim loại
Tác dụng với nhiều phi kim → oxit sắt hoặc muối
Phương trình hóa học:
![]()
(oxit sắt từ, sắt có hóa trị II và III)
2Fe + 3Cl2 → 2FeCl3
Tác dụng với dung dịch axit → muối sắt (II) + H2 .
Phương trình hóa học:
Fe + 2HCl → FeCl2 + H2
Fe + H2SO4 → FeSO4 + H2
Chú ý: Sắt không tác dụng với HNO3, H2SO4 đặc, nguội.
Tác dụng với dung dịch muối của kim loại yếu tạo → muối sắt (II).
Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
IV. Trạng thái tự nhiên
- Trong tự nhiên sắt tồn tại ở dạng hợp chất, trong các quặng sắt.
- Các quặng sắt:
+ Hematit: Hematit đỏ (Fe2O3 khan) và Hematit nâu (Fe2O3.nH2O).
+ Manhetit (Fe3O4)
+ Xiđerit (FeCO3)
+ Pirit (FeS2)
- Sắt còn có trong hồng cầu của máu, giúp vận chuyển oxi tới các tế bào.
V. Điều chế và ứng dụng của sắt
Điều chế sắt bằng phương pháp nhiệt luyện
– Khử oxit sắt bằng các chất khử (Al, C, CO, H2) ở nhiệt độ cao, dùng để điều chế sắt trong công nghiệp
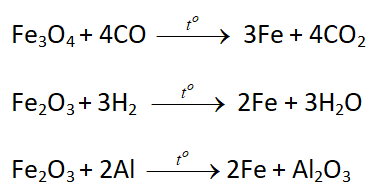
Điều chế sắt bằng phương pháp điện phân dung dịch
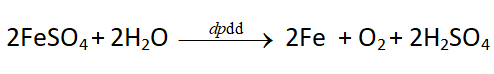
VI. Ứng dụng của sắt
Sắt và hợp kim của sắt có rất nhiều ứng dụng trong đời sống và sản xuất.
Ứng dụng của sắt trong đời sống và sản xuất
– Vật liệu cho ngành xây dựng
– Ứng dụng trong công nghiệp sản xuất ô tô và tàu thủy
– Làm đồ gia dụng và nội thất…
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Phương trình phản ứng Fe + S. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.









