Ô nguyên tố cho biết điều gì? Cách xác định ô nguyên tố?
Chúng tôi xin giới thiệu bài Ô nguyên tố cho biết điều gì? Cách xác định ô nguyên tố? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Cách xác định ô nguyên tố
Câu hỏi: Ô nguyên tố cho biết điều gì? Cách xác định ô nguyên tố? Cho ví dụ
Trả lời:
- Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối và nhiều đại lượng đặc trưng khác của nguyên tố đó.
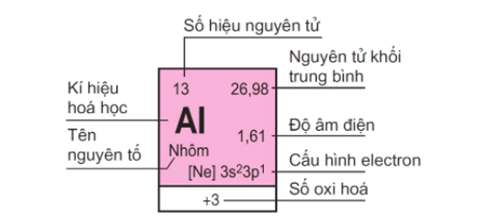
- Cách xác định ô nguyên tố: Số thứ tự ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.
Ví dụ:
Số hiệu nguyên tử của Al là 13 cho biết: Nhôm ở ô số 13, điện tích hạt nhân nguyên tử nhôm là 13+, có 13 electron; 13 proton trong nguyên tử nhôm.
1. Cách xem Bảng tuần hoàn
Để sử dụng bảng tuần hoàn một cách dễ dàng, dễ nhớ bạn cần chú ý đến những thành phần sau đây:
– Số nguyên tử: Hay còn gọi là số proton của 1 nguyên tố hóa học là số proton được tìm thấy trong hạt nhân của 1 nguyên tử. Là số điện tích của hạt nhân. Số nguyên tử giúp xác định duy nhất một nguyên tố hóa học. Số nguyên tử cũng bằng số electron trong một nguyên tử trung hòa về điện.
– Nguyên tử khối trung bình: Gần như các nguyên tố hóa học là hỗn hợp của nhiều đồng vị với tỉ lệ phần trăm số nguyên tử xác định. Nên nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỉ lệ phần trăm số nguyên tử tương ứng.
– Độ âm điện: Độ âm điện của một nguyên tử nguyên tố hóa học là khả năng hút electron của nguyên tử nguyên tố đó để tạo các liên kết hóa học. Do đó, khi độ âm điện của nguyên tử nguyên tố đó càng lớn thì tính phi kim sẽ càng mạnh và ngược lại, nếu độ âm điện của nguyên tử càng nhỏ thì tính phi kim sẽ nhỏ hay tính kim loại sẽ mạnh.
– Cấu hình electron: Cấu hình electron nguyên tử cho biết sự phân bố các electron trong lớp vỏ nguyên tử ở các trạng thái năng lượng khác nhau hay ở các vùng hiện diện của chúng.
– Số oxi hóa: Số oxi hóa Số oxi hóa cho biết số electron mà một hay nhiều nguyên tử nguyên tố sẽ trao đổi với nguyên tử nguyên tố khác khi tham gia vào một phản ứng oxi hóa khử.
– Tên nguyên tố: Là 1 chất hóa học tinh khiết, bao gồm 1 kiểu nguyên tử, được phân biệt bởi số hiệu nguyên tử, là số lượng proton có trong mỗi hạt nhân.
2. Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
Trong một chu kì
– Số electron lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
– Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim tăng dần.
* Ví dụ: Chu kì 2 gồm 8 nguyên tố từ Li đến Ne
– Số e lớp ngoài cùng của nguyên tử các nguyên tố tăng dần từ 1 đến 8
– Tính kim loại giảm dần, đồng thời tính phi kim tăng dần. Đầu chu kì là kim loại mạnh cuối chu kì là phi kim mạnh.
Trong một nhóm
Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân:
– Số lớp electron của nguyên tử tăng dần.
– Tính kim loại của các nguyên tố tăng dần đồng thời tính phi kim của các nguyên tố giảm dần.
* Ví dụ: Nhóm I gồm 6 nguyên tố từ Li đến Fr
– Số lớp electron tăng dần từ 2 đến 7. Số electron lớp ngoài cùng của nguyên tử đều bằng 1.
– Tính kim loại của các nguyên tố tăng dần. Đầu nhóm là kim loại hoạt động mạnh cuối nhóm là kim loại hoạt động rất mạnh.
3. Ý nghĩa của bảng tuần hoàn
Quan hệ giữa vị trí nguyên tố và cấu tạo của nguyên tố đó
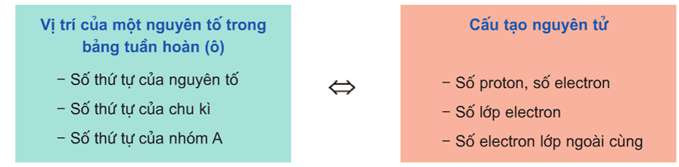
Quan hệ giữa vị trí và tính chất của nguyên tố đó
Vị trí nguyên tố cho biết:
- Các nguyên tố thuộc nhóm (IA, IIA, IIIA) trừ B và H có tính kim loại. Các nguyên tố thuộc nhóm VA, VIA, VIIA có tính phi kim (trừ Antimon, bitmut, poloni).
- Hoá trị cao nhất của nguyên tố với oxi, hóa trị với hiđro.
- Công thức của oxit cao nhất và hidroxit tương ứng.
- Công thức của hợp chất khí với H (nếu có)
- Oxit và hidroxit có tính axit hay bazo.
- S ở nhóm VI, CK3, PK
- Hoá trị cao nhất với oxi 6, với hiđro là 2.
- CT oxit cao nhất SO3, h/c với hiđro là H2S.
- SO3 là ôxit axit và H2SO4 là axit mạnh.
4. So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận
a) Trong chu kì theo chiều tăng của điện tích hạt nhân:
- Tính kim loại yếu dần, tính phi kim mạnh dần.
- Tính bazơ, của oxit và hiđroxit yếu dần, tính axit mạnh dần.
b) Trong nhóm A theo chiều tăng của điện tích hạt nhân:
- Tính kim loại mạnh dần, tính phi kim yếu dần.
* Lưu ý: khi xác định vị trí các nguyên tố nhóm B.
- Nguyên tố họ d: (n-1)dansb với a = 1 → 10 ; b = 1 → 2
+ Nếu a + b < 8 ⇒ a + b là số thứ tự của nhóm.
+ Nếu a + b > 10 ⇒ (a + b) – 10 là số thự tự của nhóm.
+ Nếu 8 ≤ a + b ≤ 10 ⇒ nguyên tố thuộc nhóm VIII B
- Nguyên tố họ f: (n-2)fansb với a = 1 → 14; b = 1 → 2
+ Nếu n = 6 ⇒ Nguyên tố thuộc họ lantan.
+ Nếu n = 7 ⇒ Nguyên tố thuộc họ acti
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Ô nguyên tố cho biết điều gì? Cách xác định ô nguyên tố? Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.










