Giải Hóa 10 Bài 11: Liên kết hydrogen và tương tác Van der Waals CTST
Giải Hóa 10 Chân trời sáng tạo Bài 11: Liên kết hydrogen và tương tác van der Waals
Giải Hóa 10 Bài 11: Liên kết hydrogen và tương tác van der Waals CTST được VnDoc biên soạn hướng dẫn bạn đọc trả lời các nội dung câu hỏi bài tập sách giáo khoa Hoá 10 CTST Bài 11. Hy vọng thông qua nội dung tài liệu bạn đọc sẽ soạn bài chuẩn bị bài thật tốt, cũng như nắm được các phương pháp giải bài tập.
>> Bài trước đó: Giải Hóa 10 Bài 10: Liên kết cộng hóa trị CTST
1. Liên kết hydrogen
Câu 1 trang 67 Hóa 10 CTST
Giữa liên kết S-H và liên kết O-H, liên kết nào phân cực mạnh hơn? Vì sao?
Hướng dẫn trả lời câu hỏi
- Xét liên kết O – H:
∆χ = 3,44 – 2,2 = 1,24 ⇒ Liên kết O-H là liên kết cộng hóa trị phân cực.
- Xét liên kết S – H:
∆χ = 2,58 – 2,2 = 0,38 ⇒ Liên kết S-H là liên kết cộng hóa trị không phân cực.
Vậy liên kết O-H phân cực mạnh hơn.
Câu 2 trang 68 Hóa 10 CTST
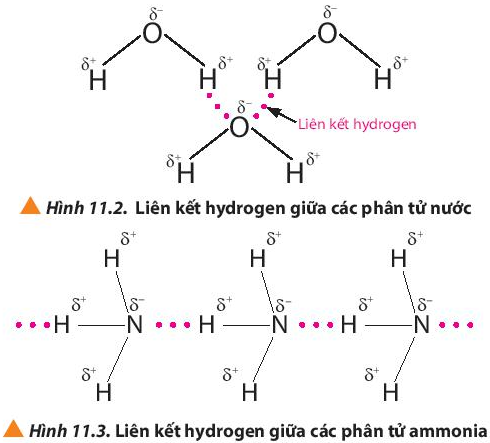
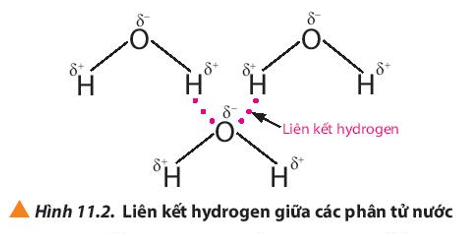
Quan sát các Hình 11.2 và 11.3, em hiểu thế nào là liên kết hydrogen giữa các phân tử?
Hướng dẫn trả lời câu hỏi
Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết.
Liên kết hydrogen thường được biểu diễn bằng dấu ba chấm (…)
Câu 3 trang 68 Hóa 10 CTST
So sánh độ bền của liên kết hydrogen với liên kết cộng hóa trị và liên kết ion.
Hướng dẫn trả lời câu hỏi
Thứ tự tăng dần độ bền liên kết: Liên kết hydrogen < liên kết cộng hóa trị < liên kết ion.
Luyện tập trang 68 Hoá 10 Chân trời sáng tạo
Điều gì đã khiến H2O có nhiệt độ sôi cao hơn H2S? Giải thích.
H2O có liên kết hydrogen liên phân tử còn H2S không có liên kết này nên H2O có nhiệt độ sôi cao hơn H2S.
Câu 4 trang 68 Hóa 10 CTST
So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích.
Hướng dẫn trả lời câu hỏi
NH3 có nhiệt độ sôi cao hơn CH4 do các phân tử NH3 có thể tạo liên kết hydrogen với nhau (còn CH4 thì không):
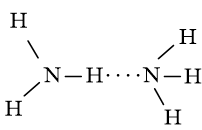
NH3 tan trong nước nhiều hơn CH4 do phân tử NH 3 có thể tạo liên kết hydrogen với nước còn CH 4 thì không.
Câu 5 trang 69 Hóa 10 CTST
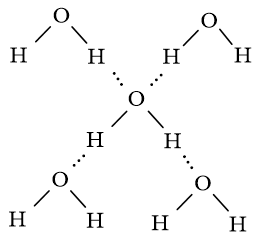
Giải thích vì sao một phân tử nước có thể tạo được liên kết hydrogen tối đa với bốn phân tử nước khác.
Hướng dẫn trả lời câu hỏi
![]()
Nguyên tử O có 2 cặp electron chưa liên kết nên có thể tạo 2 liên kết hydrogen với 2 nguyên tử H của các phân tử nước khác; 2 nguyên tử H của phân tử nước đủ điều kiện tạo liên kết hydrogen với 2 nguyên tử O của các phân tử nước khác.
Như vậy, một phân tử nước có thể tạo 4 liên kết hydrogen với các phân tử nước khác xung quanh.
2. Tương tác Van Der Waals
Câu 6 trang 69 Hóa 10 CTST
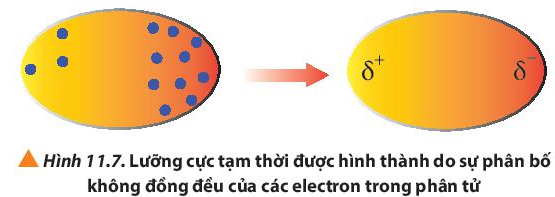
Quan sát Hình 11.7, cho biết thế nào là một lưỡng cực tạm thời?
Hướng dẫn trả lời câu hỏi
Trong các phân tử, các electron không ngừng chuyển động. Khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các lưỡng cực tạm thời .
Câu 7 trang 70 Hóa 10 CTST
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
Hướng dẫn trả lời câu hỏi
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút trái dấu.
Câu 8 trang 70 Hóa 10 CTST
Giải thích xu hướng biến đổi bán kính nguyên tử, nhiệt độ nóng chảy và nhiệt độ sôi của các nguyên tố khí hiếm trong Bảng 11.1
| Khí hiếm | He | Ne | Ar | Xe | Kr | Rn |
| Nhiệt độ nóng chảy | -272oC | -247oC | -189oC | -157oC | -119oC | -71oC |
| Nhiệt độ sôi | -260oC | -246oC | -186oC | -152oC | -108oC | -62oC |
Hướng dẫn trả lời câu hỏi
Trong bảng 11.1, theo chiều từ trái sang phải, bán kính của các nguyên tố tăng dần, nhiệt độ nóng chảy và nhiệt độ sôi giảm dần.
Giải bài tập trang 71 SGK Hóa 10 Chân trời sáng tạo
Bài 1 trang 71 Hóa 10 Chân trời sáng tạo
Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử
| A. CH4 | B. H2O | C. PH3 | D. H2S |
Hướng dẫn giải bài tập
Đáp án B
Bài 2 trang 71 Hóa 10 Chân trời sáng tạo
Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên
A. một ion dương
B. một ion âm
C. một lưỡng cực vĩnh viễn
D. một lưỡng cực tạm thời
Hướng dẫn giải bài tập
Đáp án D
Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên một lưỡng cực tạm thời.
Bài 3 trang 71 Hóa 10 Chân trời sáng tạo
Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?
| A. Ne | B. Xe | C. Ar | D. Kr |
Hướng dẫn giải bài tập
Đáp án A
Ne có nhiệt độ sôi thấp nhất do trong nhóm VIIIA, từ Ne đến Rn bán kính nguyên tử tăng đồng thời khối lượng nguyên tử tăng ⇒ Tương tác van der Waals tăng ⇒ Nhiệt độ nóng chảy và nhiệt độ sôi tăng.
Bài 4 trang 71 Hóa 10 Chân trời sáng tạo
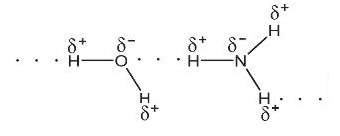
Biểu diễn liên kết hydrogen giữa các phân tử:
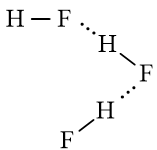
a) Hydrogen fluoride
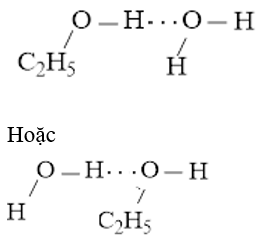
b) Ethanol (C2H5OH) và nước
Hướng dẫn giải bài tập
a) Liên kết hydrogen được hình thành giữa các phân tử HF:
b) Liên kết hydrogen được hình thành giữa H2O và C2H5OH
Bài 5 trang 71 Hóa 10 Chân trời sáng tạo
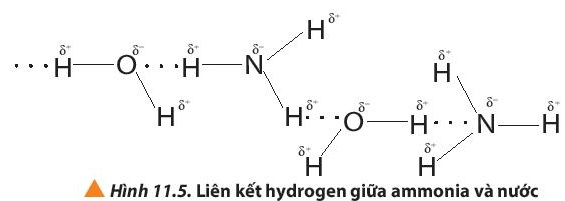
Trong hai chất ammonia (NH 3) và phosphine (PH3), theo em chất nào có nhiệt độ sôi và độ tan trong nước lớn hơn? Giải thích
Hướng dẫn giải bài tập
NH3 có nhiệt độ sôi và độ tan trong nước lớn hơn PH 3 do NH 3 có thể tạo liên kết hydrogen với nhau và với nước.
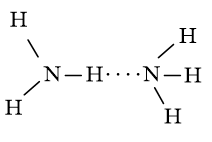
>> Bài tiếp theo: Giải Hóa 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống CTST
------------------------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa 10 Bài 11: Liên kết hydrogen và tương tác van der Waals CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.
Hãy tham gia ngay chuyên mục Hỏi đáp các lớp của VnDoc. Đây là nơi kết nối học tập giữa các bạn học sinh với nhau, giúp nhau cùng tiến bộ trong học tập. Các bạn học sinh có thể đặt câu hỏi tại đây:
- Truy cập ngay: Hỏi - Đáp học tập
Hỏi đáp, thảo luận và giao lưu về Toán, Văn, Hóa, Lý, Sinh, Tiếng Anh,... từ Tiểu Học đến Trung học phổ thông nhanh nhất, chính xác nhất.








