Giải SBT Hóa học 10 Chân trời sáng tạo bài 7
VnDoc xin giới thiệu bài Giải sách bài tập Hóa học 10 bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học sách Chân trời sáng tạo hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 10.
Bài: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Bài 7.1 trang 24 SBT Hóa học 10: Cấu hình electron nguyên tử iron: (Ar)3d64s2. Iron ở
A. ô 26, chu kì 4, nhóm VIIIA.
B. ô 26, chu kì 4, nhóm VIIIB.
C. ô 26, chu kì 4, nhóm IIA.
D. ô 26, chu kì 4, nhóm IIB.
Lời giải:
Đáp án đúng là: B
Iron ở ô 26 do (Z = 26); chu kì 4 (do có 4 lớp electron); nhóm VIIIB (do nguyên tố d, 8 electron hóa trị).
Bài 7.2 trang 24 SBT Hóa học 10: Nguyên tố X có số hiệu nguyên tử là 8
a. Nguyên tử của nguyên tố X có cấu hình electron là
A. 1s22s22p3
B. 1s22s12p5
C. 1s12s22p5
D. 1s22s22p4
b. Nguyên tố X thuộc chu kì
A. 1
B. 2
C. 3
D. 4
c. Nguyên tố X thuộc nhóm
A. VIIIB
B. VIB
C. VIIA
D. VIA
Lời giải:
a) Đáp án đúng là: D
Z = 8, cấu hình electron: 1s22s22p4.
b) Đáp án đúng là: B
X thuộc chu kì 2 do nguyên tử có 2 lớp electron.
c) Đáp án đúng là: D
X thuộc nhóm VIA do nguyên tố p, 6 electron hóa trị.
Bài 7.3 trang 24 SBT Hóa học 10: Nguyên tố X thuộc chu kì 3, nhóm IIA. Nguyên tử của nguyên tố X có cấu hình electron là
A. 1s22s22p63s1
B. 1s22s22p6
C. 1s22s22p53s4
D. 1s22s22p63s2
Lời giải:
Đáp án đúng là: D
X thuộc chu kì 3, nhóm IIA nên có 3 lớp electron, lớp ngoài cùng có 2 electron.
Cấu hình electron của X là: 1s22s22p63s2
Bài 7.4 trang 24 SBT Hóa học 10: Nguyên tử của nguyên tố X có cấu hình electron: 1s22s22p63s23p3
a. Số electron lớp ngoài cùng của X là
A. 3
B. 2
C. 6
D. 5
b. X thuộc chu kì
A. 1
B. 2
C. 3
D. 4
c. X thuộc nhóm
A. IA
B. VA
C. IIIA
D. IVA
Lời giải:
a) Đáp án đúng là: D
X có 5 electron ở lớp ngoài cùng.
b) Đáp án đúng là: C
X thuộc chu kì 3 do có 3 lớp electron.
c) Đáp án đúng là: B
X thuộc nhóm VA do nguyên tố p, 5 electron hóa trị.
Bài 7.5 trang 24 SBT Hóa học 10: Phosphorus được dùng vào mục đích quân sự như sản xuất bom, đạn cháy, đạn khói. Nguyên tố phosphorus ở ô số 15, chu kì 3, nhóm VA trong bảng tuần hoàn. Hãy cho biết:
- Cấu hình electron của phosphorus.
- Số electron lớp ngoài cùng của nguyên tử phosphorus.
- Phosphorus là kim loại hay phi kim
- Công thức oxide cao nhất của phosphorus
- Công thức hợp chất khí của phosphorus với hydrogen
- Công thức hydroxide cao nhất của phosphorus
- Oxide và hydroxide cao nhất của phosphorus có tính acid hay base.
Lời giải:
- Cấu hình electron của phosphorus: 1s22s22p63s23p3.
- Số electron lớp ngoài cùng của nguyên tử phosphorus: 5.
- Phosphorus là phi kim.
- Công thức oxide cao nhất của phosphorus: P2O5.
- Công thức hợp chất khí của phosphorus với hydrogen: PH3.
- Công thức hydroxide cao nhất của phosphorus: H3PO4.
- Oxide và hydroxide cao nhất của phosphorus có tính acid.
Giải SBT Hoá học 10 trang 25
Bài 7.6 trang 25 SBT Hóa học 10: Hợp chất khí với hydrogen của nguyên tố X có công thức XH4, được sử dụng làm tác nhân ghép nối để bám dính các sợi như sợi thủy tinh và sợi carbon. Oxide cao nhất của X chứa 53,3% oxygen về khối lượng, thường được dùng để sản xuất kính cửa sổ, lọ thủy tinh.
a. Tính nguyên tử khối của X.
b. X là nguyên tố nào?
Lời giải:
a) Hợp chất khí với hydrogen của nguyên tố X có công thức XH4. Oxide cao nhất của X là XO2. Gọi X là nguyên tử khối của X, theo bài ra ta có:
![]()
Vậy nguyên tử khối của X là 28.
b) X thuộc nhóm IVA, nguyên tử khối là 28. X là silicon (Si).
Bài 7.7 trang 25 SBT Hóa học 10: Một nguyên tố tạo hợp chất khí với hydrogen có công thức RH3, được sử dụng để trung hòa các thành phần acid của dầu thô, bảo vệ thiết bị không bị ăn mòn trong ngành công nghiệp dầu khí. Nguyên tố này chiếm 25,93% về khối lượng trong oxide cao nhất. Xác định tên nguyên tố.
Lời giải:
Hợp chất với hydrogen là RH3 nên oxide cao nhất có công thức R2O5.
Gọi R là nguyên tử khối của R. Ta có:
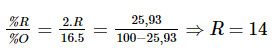
Vậy R là nitrogen (N).
Bài 7.8 trang 25 SBT Hóa học 10: Oxide cao nhất của nguyên tố R thuộc nhóm VIA có 60% oxygen về khối lượng, là một sản phẩm trung gian để sản xuất acid H2SO4 có tầm quan trọng bậc nhất trong công nghiệp. Hãy xác định nguyên tố R và viết công thức oxide cao nhất.
Lời giải:
Nguyên tố R thuộc nhóm VIA nên oxide cao nhất có dạng RO3.
Ta có:
![]()
Vậy R là sulfur (S), công thức oxide cao nhất là SO3.
Bài 7.9 trang 25 SBT Hóa học 10: Oxide cao nhất của nguyên tố R có dạng R2O5, được sử dụng làm chất hút ẩm cho chất lỏng và khí. Hợp chất của R với hydrogen ở thể khí có chứa 8,82% hydrogen về khối lượng, là khí rất độc, gây chết với các triệu chứng khó hô hấp, đau đầu, chóng mặt, buồn nôn. Xác định công thức phân tử của hợp chất khí của R với hydrogen.
Lời giải:
Oxide cao nhất của nguyên tố R có dạng R2O5 nên R thuộc nhóm VA.
Hợp chất với hydrogen là RH3.
Theo bài ra, ta có:
![]()
Vậy R là phosphorus (P), công thức hợp chất với hydrogen là PH3.
Bài 7.10 trang 25 SBT Hóa học 10: Oxide cao nhất của một nguyên tố R chứa 72,73% oxygen. Tuy không phải là khí quá độc nhưng với nồng độ lớn thì sẽ làm giảm nồng độ oxygen trong không khí, gây ra các tác hại như mệt mỏi, khó thở, kích thích thần kinh, tăng nhịp tim và các rối loạn khác. Hợp chất khí với hydrogen chứa 75% nguyên tố đó. Hợp chất này thường được sử dụng làm nhiên liệu cho các lò nướng, nhà cửa, máy nước nóng, lò nung, xe ô tô. Viết công thức oxide cao nhất và hợp chất khí với hydrogen của nguyên tố R.
Lời giải:
Hợp chất với hydrogen có công thức là RHx.
Hợp chất oxide cao nhất có công thức là R2O8 – x.
Oxide cao nhất của nguyên tố R chứa 72,73% oxygen nên:
![]()
Hợp chất khí với hydrogen chứa 75% nguyên tố R nên:
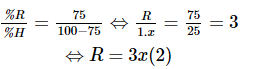
Thay (2) vào (1) được x = 4 ⇒ R = 12, vậy R là carbon (C).
Oxide cao nhất của R là CO2 và hợp chất khí với hydrogen là CH4.
>>>> Bài tiếp theo: Giải SBT Hóa học 10 Chân trời sáng tạo bài: Ôn tập chương 2
Như vậy, VnDoc đã gửi tới các bạn Giải Hóa học 10 bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học. Ngoài ra, các em học sinh có thể tham khảo môn Ngữ văn 10 Kết nối tri thức tập 1, Vật Lý 10 Kết nối tri thức và Toán 10 Kết nối tri thức tập 1, Toán 10 Kết nối tri thức tập 2, Sinh 10 Kết nối tri thức đầy đủ khác.









