Giải SBT Hóa học 10 Chân trời sáng tạo bài 11
Chúng tôi xin giới thiệu bài Giải SBT Hóa học 10 bài 11: Liên kết hydrogen và tương tác Van der waals được VnDoc biên soạn hướng dẫn bạn đọc trả lời các nội dung câu hỏi bài tập môn Hóa học 10 Chân trời sáng tạo.
Bài: Liên kết hydrogen và tương tác Van der waals
Bài 11.1 trang 39 SBT Hóa học 10: Hợp chất nào sau đây tạo được liên kết hydrogen liên phân tử?
A. H2S
B. PH3
C. HI
D. CH3OH
Lời giải:
CH3OH tạo được liên kết hydrogen liên phân tử:
A. độ âm điện của chlorine nhỏ hơn của nitrogen
B. phân tử NH3 chứa nhiều nguyên tử hydrogen hơn phân tử HCl
C. tổng số nguyên tử trong phân tử NH3 nhiều hơn so với phân tử HCl
D. kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
Lời giải:
Đáp án đúng là: D
Giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
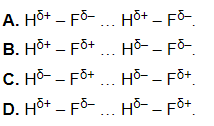
Lời giải:
Đáp án đúng là: A
Bài 11.4 trang 39 SBT Hóa học 10: Điều nào sau đây đúng khi nói về liên kết hydrogen liên phân tử?
A. Là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H – F, H = N, H – O ở phân tử này) với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở một phân tử khác.
B. Là lực hút giữa các phân tử khác nhau
C. Là lực hút tĩnh điện giữa các ion trái dấu
D. Là lực hút giữa các nguyên tử trong một hợp chất cộng hóa trị
Lời giải:
Đáp án đúng là: A
Liên kết hydrogen liên phân tử là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H – F, H = N, H – O ở phân tử này) với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở một phân tử khác.
Bài 11.5 trang 40 SBT Hóa học 10: Điều nào sau đây đúng khi nói về liên kết hydrogen nội phân tử?
A. Là lực hút giữa các proton của nguyên tử này với các electron ở nguyên tử khác.
B. Là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H – F, H – N, H – O) ở một phân tử với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở ngay chính phân tử đó.
C. Là lực hút giữa các ion trái dấu
D. Là lực hút giữa các phân tử có chứa nguyên tử hydrogen.
Lời giải:
Đáp án đúng là: B
Liên kết hydrogen nội phân tử là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H – F, H – N, H – O) ở một phân tử với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở ngay chính phân tử đó.
A. các nguyên tử trong phân tử
B. các electron trong phân tử
C. các proton trong hạt nhân
D. các neutron và proton trong hạt nhân
Lời giải:
Đáp án đúng là: B
Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tam thời xuất hiện là do sự chuyển động của các electron trong phân tử, đó là lúc electron tập trung về một phía trong phân tử.
Bài 11.7 trang 40 SBT Hóa học 10: Trong các khí hiếm sau, khí hiếm có nhiệt độ sôi cao nhất là
A. Ne
B. Xe
C. Ar
D. Kr
Lời giải:
Đáp án đúng là: B
Trong 4 nguyên tử Ne, Xe, Ar, Kr thì Xe có khối lượng phân tử lớn nhất nên tương tác van der Waals giữa các phân tử Xe là lớn nhất, dẫn đến khí hiếm Xe có nhiệt độ sôi cao nhất.
Bài 11.8 trang 40 SBT Hóa học 10: Biểu diễn liên kết hydrogen giữa các phân tử sau:
a. methanol (CH3OH) và nước.
b. ethylene glycol (HOCH2CH2OH) và nước
Từ đó nhận xét tính tan của methanol và ethylene glycol trong nước.
Lời giải:
a)
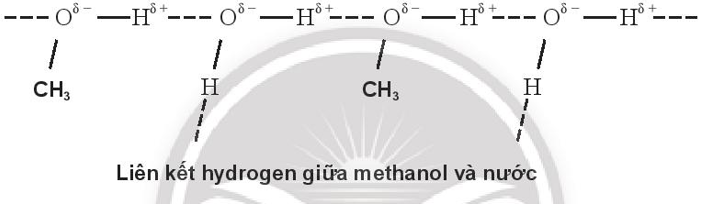
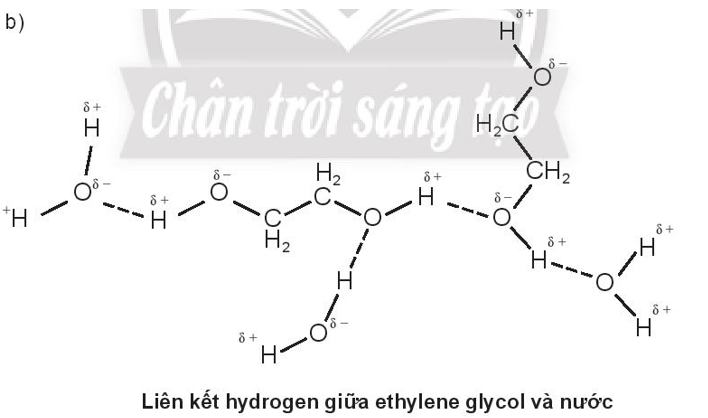
Do methanol và ethylene glycol tạo được liên kết hydrogen với nước nên methanol và ethylene glycol đều tan vô hạn trong nước.
Lời giải:
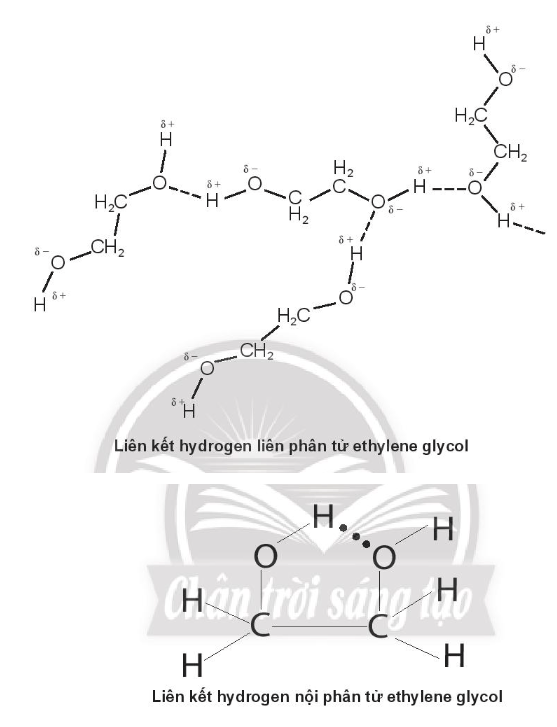
Bài 11.10 trang 40 SBT Hóa học 10: Hãy so sánh tương tác van der Waals với liên kết ion.
Lời giải:
Tương tác van der Waals và liên kết ion đều là các lực hút tĩnh điện. Tuy nhiên, tương tác van der Waals là lực hút tĩnh điện giữa các phân tử trung hòa nên yếu hơn nhiều so với liên kết ion là lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Lời giải:
Oxygen có khối lượng phân tử cao hơn nitrogen, do đó tương tác van der Waals giữa các phân tử oxygen mạnh hơn so với nitrogen. Kết quả là oxygen lỏng có nhiệt độ sôi cao hơn nitrogen lỏng.
Thực nghiệm đã chứng minh, oxygen lỏng sôi ở -183oC, còn nitrogen lỏng sôi ở -195,8oC.
Lời giải:
Phân tử có kích thước lớn thường đi đôi với nhiều electron. Chính vì vậy, khả năng tạo các ion lưỡng cực tức thời và lưỡng cực cảm ứng của các phân tử có kích thước lớn cũng nhiều hơn, từ đó tương tác van der Waals giữa các phân tử lớn cũng mạnh hơn so với các phân tử có kích thước nhỏ.
Lời giải:
Khi đi từ F2 đến I2, do khối lượng phân tử của các halogen tăng dần làm tương tác van der Waals giữa các phân tử halogen cũng tăng dần, kết quả các phân tử halogen “dính” với nhau chặt hơn, nên fluorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
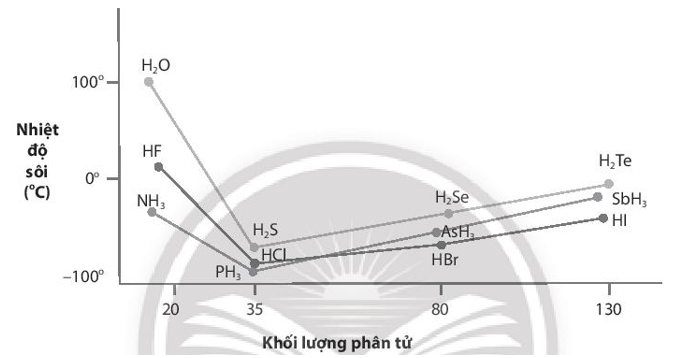
a. Giải thích nhiệt độ sôi cao bất thường của các hợp chất với hydrogen của các nguyên tố đầu tiên trong mỗi nhóm.
b. Nhận xét nhiệt độ sôi của các hợp chất với hydrogen của các nguyên tố còn lại ở mỗi nhóm và giải thích nguyên nhân sự biến đổi nhiệt độ sôi của chúng.
Lời giải:
a) Các nguyên tố đầu tiên trong mỗi nhóm VA, VIA, VIIA (N, O, F) có kích thước nhỏ và độ âm điện lớn, kết quả trong các hợp chất NH3; H2O; HF xuất hiện liên kết hydrogen liên phân tử làm cho các hợp chất này có nhiệt độ sôi cao bất thường so với các hợp chất còn lại trong mỗi nhóm.
b) Hợp chất với hydrogen của các nguyên tố còn lại trong mỗi nhóm có nhiệt độ sôi tăng dần khi khối lượng phân tử của chúng tăng. Vì khi khối lượng phân tử tăng, tương tác van der Waals giữa các phân tử trong hợp chất cũng tăng dẫn đến nhiệt độ sôi của chúng dần cao hơn.
Lời giải:
Hai hợp chất pentane (CH3CH2CH2CH2CH3) và neopentane ((CH3)4C) có cùng công thức phân tử, tức cùng khối lượng phân tử. Tuy nhiên, phân tử neopentane có dạng hình cầu nên diện tích bề mặt tiếp xúc giữa các phân tử neopentane nhỏ hơn so với các phân tử pentane. Do đó, lực tương tác van der Waals giữa các phân tử pentane mạnh hơn giữa các phân tử neopentane nên nhiệt độ sôi và nhiệt độ nóng chảy của pentane cao hơn so với neopentane.
Thực nghiệm đã chứng minh:
Nhiệt độ sôi và nhiệt độ nóng chảy của pentane: -130oC và 36oC.
Nhiệt độ sôi và nhiệt độ nóng chảy của neopentane: -16,6oC và 9,5oC.
Lời giải:
CHCl3 là một phân tử phân cực, trong khi CCl4 là một phân tử không phân cực. Như vậy, CHCl3 đáng lí phải có nhiệt độ sôi cao hơn CCl4. Tuy nhiên, thực tế CCl4 lại có nhiệt độ sôi cao là 76,8oC, cao hơn so với CHCl3 là 61,2oC. Điều này được giải thích do phân tử CCl4 có kích thước lớn hơn CHCl3 nên có số electron cũng nhiều hơn CHCl3, do đó tương tác van der Waals giữa các phân tử CCl4 mạnh hơn CHCl3, làm cho CCl4 có nhiệt độ sôi cao hơn CHCl3.
>>>> Bài tiếp theo: Giải SBT Hóa học 10 Chân trời sáng tạo bài 12
Như vậy, VnDoc đã gửi tới các bạn Giải Hóa học 10 bài 11: Liên kết hydrogen và tương tác Van der waals. Ngoài ra, các em học sinh có thể tham khảo môn Ngữ văn 10 Kết nối tri thức tập 1, Vật Lý 10 Kết nối tri thức và Toán 10 Kết nối tri thức tập 1, Toán 10 Kết nối tri thức tập 2, Sinh 10 Kết nối tri thức đầy đủ khác.









