Giải Hóa 10 Bài 3: Nguyên tố hóa học CTST
Giải Hóa 10 Chân trời sáng tạo Bài 3: Nguyên tố hóa học
Giải Hóa 10 Bài 3: Nguyên tố hóa học CTST được VnDoc biên soạn hướng dẫn bạn đọc trả lời các nội dung câu hỏi sách giáo khoa Hóa 10 bài 3 chân trời sáng tạo.
Hy vọng thông qua nội dung câu hỏi sẽ giúp bạn đọc chuẩn bị, soạn bài thật tốt trước khi học, cũng như nắm được phương pháp giải các dạng câu hỏi bài tập trong nội dung bài học. Mời các bạn tham khảo chi tiết nội dung dưới đây.
>> Bài trước đó: Giải Hóa 10 Bài 2: Thành phần của nguyên tử CTST
Mở đầu trang 20 Hóa 10 Chân trời sáng tạo
Kim cương và than chì có vẻ ngoài khác nhau. Tuy nhiên, chúng đều được tạo thành từ cùng một nguyên tố hóa học là nguyên tố carbon (C). Nguyên tố hóa học là gì? Một nguyên tử của nguyên tố hóa học có những đặc trưng cơ bản nào?
Hướng dẫn trả lời câu hỏi
Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân.
Số đơn vị điện tích hạt nhân nguyên tử (còn gọi là số hiệu nguyên tử) của một nguyên tố hóa học và số khối được xem là những đặc trưng cơ bản của nguyên tử.
A. Nội dung câu hỏi thảo luận và củng cố
I. Hạt nhân nguyên tử
Câu 1: Quan sát Hình 3.1, cho biết nguyên tử nitrogen có bao nhiêu proton, neutron và electron.
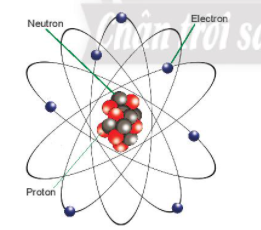
Hướng dẫn trả lời câu hỏi
Nguyên tử nitrogen có 7 proton, 7 neutron và 7 electron
Câu 2: Điện tích hạt nhân của nguyên tử nitrogen có giá trị là bao nhiêu?
Hướng dẫn trả lời câu hỏi
Nguyên tử nitrogen có 7 electron
=> Số đơn vị điện tích hạt nhân: Z = 7
Điện tích hạt nhân = +Z = +7
Câu hỏi bổ sung: Nguyên tử sodium có 11 proton. Cho biết số đơn vị điện tích hạt nhân và số electron của nguyên tử này.
Hướng dẫn trả lời câu hỏi
Nguyên tử sodium có 11 proton
=> Số đơn vị điện tích hạt nhân (Z) = số proton = số electron = 11
Vậy số đơn vị điện tích hạt nhân và số electron của nguyên tử sodium đều bằng 11
Câu 3: Bổ sung những dữ liệu còn thiếu trong bảng 3.1.
| Tên nguyên tố | Kí hiệu | P | N | Số khối (A) | E |
| Helium | He | 2 | 2 | 4 | 2 |
| Lithium | Li | 3 | 4 | 7 | ? |
| Nitrogen | N | 7 | ? | 14 | 7 |
| Oxygen | O | 8 | 8 | ? | 8 |
Hướng dẫn trả lời câu hỏi
Bảng chi tiết
| Tên nguyên tố | Kí hiệu | P | N | Số khối (A) | E |
| Helium | He | 2 | 2 | 4 | 2 |
| Lithium | Li | 3 | 4 | 7 | ? |
| Nitrogen | N | 7 | 7 | 14 | 7 |
| Oxygen | O | 8 | 8 | 16 | 8 |
II. Nguyên tố hóa học
Câu 4. Nguyên tố carbon có số hiệu nguyên tử là 6. Xác định điện tích hạt nhân của nguyên tử này.
Hướng dẫn trả lời câu hỏi
Số hiệu nguyên tử của một nguyên tố được quy ước bằng số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó
Vậy điện tích hạt nhân của nguyên tử carbon là 6
Câu 5. Quan sát Hình 3.2, cho biết số proton, số neutron, số electron và điện tích hạt nhân của từng loại nguyên tử của nguyên tố hydrogen
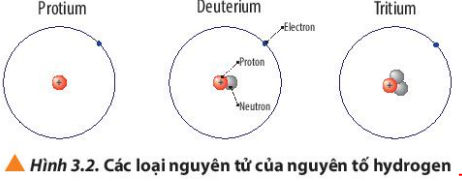
Hướng dẫn trả lời câu hỏi
- Nguyên tử Protium
+ 1 electron, 1 proton
+ Điện tích hạt nhân = +1
- Nguyên tử Deuterium
+ 1 electron, 1 proton, 1 neutron
+ Điện tích hạt nhân = +1
- Nguyên tử Tritium
+ 1 electron, 1 proton, 2 neutron
+ Điện tích hạt nhân = +1
Câu 6. Kí hiệu nguyên tử cho biết những thông tin nào?
Hướng dẫn trả lời câu hỏi
![]() \(_{Z}^{A}X\)
\(_{Z}^{A}X\)
Kí hiệu hóa học cho biết:
Kí hiệu nguyên tố hóa học (X)
Số hiệu nguyên tử (Z) => Số proton, số electron, điện tích hạt nhân, số đơn vị điện tích hạt nhân
Số khối (A) => Số neutron = số khối – số proton
Câu hỏi thảo luận: Viết kí hiệu nguyên tử của nguyên tố oxygen. Biết nguyên tử của nguyên tố này có 8 electron và 8 neutron
Hướng dẫn trả lời câu hỏi
Nguyên tử oxygen có 8 electron
=> Số E = Số P = Z = 8
- Nguyên tử oxygen có 8 neutron
=> Số khối A = P + N = 8 + 8 = 16
=> Kí hiệu nguyên tử: ![]() \(_{8}^{16}O\)
\(_{8}^{16}O\)
III. Đồng vị
Câu 7: Quan sát Hình 3.2, so sánh điểm giống và khác nhau giữa các loại nguyên tử của nguyên tố hydrogen

Hướng dẫn trả lời câu hỏi
Giống nhau: đều có 1 proton và 1 electron
Khác nhau: Số lượng hạt neutron khác nhau
- Protium: Không có neutron
- Deuterium: có 1 neutron
- Tritium: có 2 neutron
Câu hỏi bổ sung: Kim cương là một trong những dạng tồn tại của nguyên tố carbon trong tự nhiên. Nguyên tố này có hai đồng vị bền với số khối lần lượt là 12 và 13. Hãy viết kí hiệu nguyên tử của hai đồng vị này.
Hướng dẫn trả lời câu hỏi
Carbon có số khối = 12 => Kí hiệu của đồng vị này là ![]() \(_{6}^{12}O\)
\(_{6}^{12}O\)
Carbon có số khối = 13 => Kí hiệu của đồng vị này là ![]() \(_{6}^{13}O\)
\(_{6}^{13}O\)
IV. Nguyên tử khối và nguyên tử khối trung bình
Câu 8: Nguyên tử của nguyên tố magnesium (Mg) có 12 proton và 12 neutron. Nguyên tử khối của Mg là bao nhiêu?
Hướng dẫn trả lời câu hỏi
Nguyên tử Mg có 12 proton, 12 neutron
=> Số khối: A = P + N = 12 + 12
- Mà nguyên tử khối của 1 nguyên tử = số khối
=> Nguyên tử khối của Mg = 24
Câu 9: Trong tự nhiên, nguyên tố copper có hai đồng vị với phần trăm số nguyên tử tương ứng là ![]() \(_{29}^{63}Cu\) (69,15%) và
\(_{29}^{63}Cu\) (69,15%) và ![]() \(_{29}^{65}Cu\)Cu (30,85%). Hãy tính nguyên tử khối trung bình của nguyên tố copper.
\(_{29}^{65}Cu\)Cu (30,85%). Hãy tính nguyên tử khối trung bình của nguyên tố copper.
Hướng dẫn trả lời câu hỏi
Ta có: 63Cu chiếm 69,15%; 65Cu chiếm 30,85%
![]() \(M_{Cu}= \frac{69,15.63+30,85.65}{100} =63,617\)
\(M_{Cu}= \frac{69,15.63+30,85.65}{100} =63,617\)
Vậy nguyên tử khối trung bình của Cu là 63,617
B. Giải bài tập sách giáo khoa Chân trời sáng tạo Hóa 10 Bài 3
Câu 1 trang 25 SGK Hóa 10 CTST
Một nguyên tử X gồm 16 proton, 16 electron và 16 neutron. Nguyên tử X có kí hiệu là:
| A. |
B. |
C. |
D. |
Hướng dẫn trả lời bài tập
Đáp án C
Nguyên tử X có 16 proton
Nguyên tử đó là S
P = Z = 16
A = P + N = 16 + 16 = 32
=> Kí hiệu nguyên tử X: ![]() \(_{16}^{32}S\)
\(_{16}^{32}S\)
Câu 2 trang 25 SGK Hóa 10 CTST
Silicon là nguyên tố được sử dụng để chế tạo vật liệu bán dẫn, có vai trò quan trọng trong sản xuất công nghiệp. Trong tự nhiên, nguyên tố này có 3 đồng vị với số khối lần lượt là 28, 29, 30. Viết kí hiệu nguyên tử cho mỗi đồng vị của silicon. Biết nguyên tố silicon có số liệu nguyên tử là 14.
Hướng dẫn trả lời câu hỏi
Nguyên tố silicon có số hiệu nguyên tử là 14 và số khối lần lượt là:
Số khối = 28 => Kí hiệu nguyên tử ![]() \(_{14}^{28}Si\)
\(_{14}^{28}Si\)
Số khối = 29 => Kí hiệu nguyên tử ![]() \(_{14}^{29}Si\)
\(_{14}^{29}Si\)
Số khối = 30 => Kí hiệu nguyên tử ![]() \(_{14}^{30}Si\)
\(_{14}^{30}Si\)
>> Thảo luận thêm đáp án tại: Silicon là nguyên tố được sử dụng để
Câu 3 trang 25 SGK Hóa 10 CTST
Hoàn thành những thông tin chưa biết trong bảng sau:
| Đồng vị | ? | ? | ? | ? | |
| Số hiệu nguyên tử | ? | ? | ? | 9 | 11 |
| Số khối | ? | ? | ? | ? | 23 |
| Số proton | 16 | ? | ? | ? | ? |
| Số netron | 16 | 20 | ? | 10 | ? |
| Số electron | ? | 20 | ? | ? | ? |
Hướng dẫn trả lời câu hỏi
Chi tiết bảng
| Đồng vị | |||||
| Số hiệu nguyên tử | 16 | 20 | 30 | 9 | 11 |
| Số khối | 32 | 40 | 65 | 19 | 23 |
| Số proton | 16 | 20 | 30 | 9 | 11 |
| Số netron | 16 | 20 | 35 | 10 | 12 |
| Số electron | 16 | 20 | 30 | 9 | 11 |
Câu 4 trang 25 SGK Hóa 10 CTST
Trong tự nhiên, magnesium có 3 đồng vị bền là 24Mg, 25Mg và 26Mg. Phương pháp phổ khối lượng xác nhận đồng vị 26Mg chiếm tỉ lệ phần trăm số nguyên tử là 11%. Biết rằng nguyên tử khối trung bình của Mg là 24,32. Tính % số nguyên tử của đồng vị 24Mg, 25Mg?
Hướng dẫn trả lời câu hỏi
Gọi phần trăm đồng vị 24Mg là a
=> Phần trăm đồng vị 25Mg là: 100 – 11 – a = (89 – a)
Nguyên tử khối trung bình của Mg = 24,32
Áp dụng công thức
=> ![]() \(\frac{ a.24+(89−a).25+11.26 }{100}= 24,32\)
\(\frac{ a.24+(89−a).25+11.26 }{100}= 24,32\)
=> a = 79%
=> Phần trăm đồng vị 24Mg là 79%
=> Phần trăm đồng vị 25Mg là: 10%
>> Thảo luận thêm đáp án tại: Trong tự nhiên, magnesium có 3 đồng vị ...
>> Bài tiếp theo: Giải Hóa 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử CTST
C. Câu hỏi luyện tập
>> Trên đây là nội dung câu hỏi trắc nghiệm Online có đáp án, bạn đọc có thể tự đánh giá kiến thức sau mỗi bài học thông qua bài làm.
----------------------------------------------------------
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa 10 Bài 3: Nguyên tố hóa học CTST. Ngoài ra, các em học sinh có thể tham khảo môn Hóa 10 Cánh Diều, Lý 10 Cánh Diều và Toán 10 Chân trời sáng tạo tập 1, Sinh 10 Chân trời sáng tạo đầy đủ khác.
Hãy tham gia ngay chuyên mục Hỏi đáp các lớp của VnDoc. Đây là nơi kết nối học tập giữa các bạn học sinh với nhau, giúp nhau cùng tiến bộ trong học tập. Các bạn học sinh có thể đặt câu hỏi tại đây:
- Truy cập ngay: Hỏi - Đáp học tập
Hỏi đáp, thảo luận và giao lưu về Toán, Văn, Hóa, Lý, Sinh, Tiếng Anh,... từ Tiểu Học đến Trung học phổ thông nhanh nhất, chính xác nhất.








