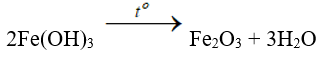Fe2O3 có màu gì?
Chúng tôi xin giới thiệu bài Fe2O3 có màu gì? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Fe2O3 có màu gì?
Câu hỏi: Fe2O3 có màu gì?
Trả lời:
Fe2O3 là chất rắn màu nâu đỏ, không tan trong nước, nhiệt độ nóng chảy 1556°C. Fe2O3 là một oxit khó nóng chảy. Trong môi trường nung khử, Fe2O3 dễ dàng bị khử thành FeO bởi Cacbon hoặc các hợp chất của lưu huỳnh và trở thành chất trợ chảy.
I. Định nghĩa
- Định nghĩa: Fe2O3 là một oxit của sắt, Fe2O3 là dạng phổ biến nhất của sắt oxit tự nhiên. Ngoài ra có thể lấy chất này từ đất sét màu đỏ.
- Công thức phân tử: Fe2O3
II. Tính chất vật lí
- Là chất rắn, nâu đỏ, không tan trong nước.
II. Tính chất hoá học
1. Tính oxit bazơ
- Fe2O3 tác dụng với dung dịch axit tạo ra dung dịch bazơ tạo ra dung dịch muối và nước.
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2. Tính oxi hóa
- Fe2O3 là chất oxi hóa khi tác dụng với các chất khử mạnh ở nhiệt độ cao như: H2, CO, Al:
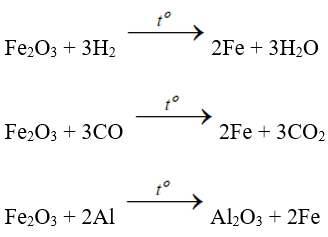
3. Ở nhiệt độ cao, Fe2O3 bị CO hoặc H2 khử thành Fe.
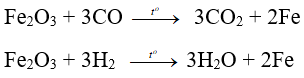
4. Phản ứng nhiệt nhôm:
![]()
IV. Điều chế
- Fe2O3 là thành phần chính của quặng hematit.
- Nhiệt phân Fe(OH)3
V. Ứng dụng
- Fe2O3 có vai trò rất quan trọng trong việc tạo màu cho các loại men gốm sứ và giúp làm giảm rạn men.
- Các hợp chất sắt là các chất tạo màu phổ biến nhất trong ngành gốm. Sắt có thể biểu hiện khác biệt tùy thuộc môi trường lò, nhiệt độ nung, thời gian nung và tùy theo thành phần hoá học của men. Do đó có thể nói nó là một trong những nguyên liệu lý thú nhất.
- Ngoài chức năng tạo màu, thêm Fe2O3 vào men giúp giảm rạn men (nếu hàm lượng sử dụng dưới 2%).
VI. Bài tập ví dụ
Câu 1. Hòa tan 5 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ, thu được 0,56 lít hidro (đktc) và dung dịch X. Cho dung dịch X tác dụng với dd NaOH lấy dư. Lấy kết tủa thu được đem nung nóng trong không khí đến khối lượng không đổi thu được chất rắn Y. Khối lượng chất rắn Y là:
- 8 gam.
- 7 gam.
- 6 gam.
- 7,5 gam.
Đáp án C
Giải
nH2 (đktc) = 0,56:22,4 = 0,025 (mol)
Phương trình hóa học
Fe + 2HCl → FeCl2 + H2↑ (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
Theo PTHH (1): nFe = nH2 = 0,025 (mol) → mFe = 0,025.56 = 1,4 (g)
→ mFe2O3 = mhh - mFe = 5 - 1,4 = 3,6 (g) → nFe2O3 = 3,6 : 160 = 0,0225 (mol)
Theo phương trình hóa học (1): nFeCl2 = nFe = 0,025 (mol)
Theo phương trình hóa học (2): nFeCl3 = 2nFe2O3 = 2.0,025 = 0,05 (mol)
Dung dịch X thu được chứa: FeCl2: 0,025 (mol) và FeCl3: 0,05 (mol)
FeCl2 + 2NaOH → Fe(OH)2 + NaCl
FeCl3 + 3NaOH → Fe(OH)3 + NaCl
Kết tủa thu được Fe(OH)2 và Fe(OH)3
Nung 2 kết tủa này thu được Fe2O3
Bảo toàn nguyên tố "Fe": 2nFe2O3 = nFeCl2 + nFeCl3 → nFe2O3 = (0,025 + 0,05)/2 = 0,0375 (mol)
→ mFe2O3 = 0,0375.160 = 6 (g)
Câu 2. Quặng sắt manhetit có thành phần chính là:
- FeS2.
- Fe3O4.
- Fe2O3.
- FeCO3.
Giải:
Quặng hematit đỏ là Fe2O3
Quặng hematit nâu là Fe2O3.nH2O
Quặng xiđerit là FeCO3
Quặng manhetit là Fe3O4
Đáp án: B
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Fe2O3 có màu gì? Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.