Giải Hóa học 10 Kết nối tri thức bài 21
Giải Hóa học 10 bài 21: Nhóm halogen sách Kết nối tri thức được biên soạn hướng dẫn bạn đọc trả lời các nội câu hỏi bài tập SGK Hóa 10 Kết nối tri thức. Hy vọng thông qua nội dung tài liệu, sẽ giúp bạn đọc hoàn thành tốt các nội dung câu hỏi.
Bài: Nhóm halogen
Mở đầu trang 104 Hóa học 10: Trong tự nhiên, một số phi kim như carbon, nitrogen, oxygen tồn tại ở cả dạng đơn chất và hợp chất, còn các halogen đều chỉ tồn tại ở dạng hợp chất. Vì sao có sự khác biệt này?
Phương pháp giải:
Do nguyên tử của các nguyên tố này hoạt động hóa học rất mạnh
Lời giải:
- Các nguyên tố halogen chỉ tồn tại ở dạng hợp chất trong tự nhiên do nguyên tử của các nguyên tố này hoạt động hóa học rất mạnh
- Halogen có ái lực electron lớn. Nguyên tử halogen X với 7 electron lớp ngoài cùng
=> Dễ dàng nhận thêm 1 electron để tạo thành ion âm X- có cấu hình electron của khí hiếm
=> Các halogen mau chóng tạo liên kết với các nguyên tử nguyên tố khác
I. Trạng thái tự nhiên
Câu hỏi 1 trang 105 Hóa học 10: Kể tên một số hợp chất phổ biến của halogen trong tự nhiên
Phương pháp giải:
Trong tự nhiên, halogen thường tồn tại ở dạng muối
Lời giải:
- Clo: NaCl có trong nước biển và đại dương, KCl có trong khoáng vật như KCl.MgCl2.6H2O và NaCl.KCl
- Flo: Phần lớn có trong 2 loại khoáng vật là florit (CaF2) và criolit (Na3AlF6 hay AlF3.3NaF)
- Brom: KBr, NaBr, MgBr2
- Iot: tồn tại dưới dạng muối iotua như NaI, KI, trong tuyến giáp iot tồn tại dưới dạng hợp chất hữu cơ như tetraiodothyronine hoặc triiodothyronine
II. Cấu tạo nguyên tử, phân tử
Câu hỏi 2 trang 106 Hóa học 10: Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất. Viết công thức một vài hợp chất của halogen thường được dùng trong thực tế
Phương pháp giải:
Tham khảo trên sách, báo, tivi, internet
Lời giải:
- Clo: NaCl có trong nước biển và đại dương, KCl có trong khoáng vật như KCl.MgCl2.6H2O và NaCl.KCl
- Flo: Phần lớn có trong 2 loại khoáng vật là florit (CaF2) và criolit (Na3AlF6 hay AlF3.3NaF)
- Brom: KBr, NaBr, MgBr2
- Iot: tồn tại dưới dạng muối iotua như NaI, KI, trong tuyến giáp iot tồn tại dưới dạng hợp chất hữu cơ như tetraiodothyronine hoặc triiodothyronine
Câu hỏi 3 trang 106 Hóa học 10: Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim
Mô tả sự hình thành liên kết trong phân tử NaCl và HCl để minh họa
Phương pháp giải:
- NaCl: liên kết ion
- HCl: Liên kết cộng hóa trị
Lời giải:
- Sự hình thành liên kết trong phân tử NaCl: Nguyên tử chlorine đã nhận 1 electron của nguyên tử sodium để tạo thành Na+ và Cl-
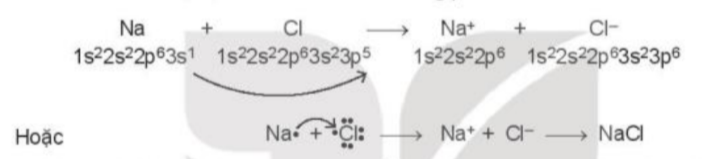
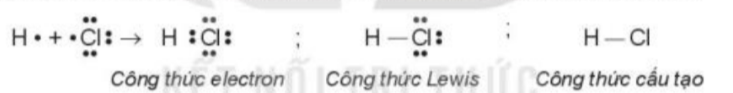
- Sự hình thành liên kết trong phân tử HCl: Mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl
III. Tính chất vật lí
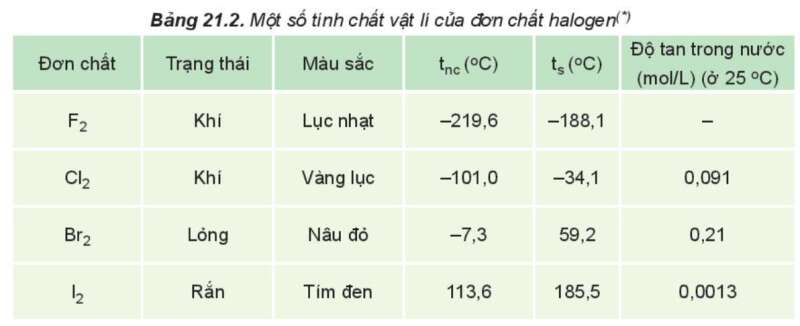
Câu hỏi 4 trang 107 Hóa học 10: Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các halogen và giải thích.
Phương pháp giải:
- Tương tác van der Waals
- Khối lượng phân tử
Lời giải:
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
+ Tương tác van der Waals giữa các phân tử tăng
+ Khối lượng phân tử tăng
IV. Tính chất hóa học
Câu hỏi 5 trang 108 Hóa học 10: Xác định chất oxi hóa, chất khử trong phản ứng sodium và iron với chlorine, dùng mũi tên chỉ rõ sự nhường electron từ chất khử sang chất oxi hóa
Phương pháp giải:
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron
Lời giải:
2Na0 + Cl20→ 2 Na+ 1Cl−1
- Na0 nhường electron thành Na+1 => Na là chất khử
- Cl0 nhận electron thành Cl-1 => Cl2 là chất oxi hóa
2Fe0+3Cl20→2Fe + 3Cl3−1
- Fe0 nhường electron thành Fe+3 => Fe là chất khử
- Cl0 nhận electron thành Cl-1 => Cl2 là chất oxi hóa
Câu hỏi 6 trang 109 Hóa học 10: Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt. Tính khối lượng Cl2 nhà máy cần dùng để khử trùng 80 000 m3 nước sinh hoạt
Phương pháp giải:
Bước 1: Đổi 80 000 m3 = 8.107 dm3 = 8.107 L
Bước 2: 5 mg Cl2 để khử trùng 1 L nước
x mg Cl2 để khử trùng 8.107 L nước
Lời giải:
Đổi 80 000 m3 = 8.107 dm3 = 8.107 L
5 mg Cl2 để khử trùng 1 L nước
x mg Cl2 để khử trùng 8.107 L nước
=> x = 5 x 8.107 = 4.108 (mg) = 400 kg
Vậy cần 400 kg Cl2 để khử trùng 80 000 m3 nước sinh hoạt
Câu hỏi 7 trang 110 Hóa học 10: Khí Cl2 phản ứng với dung dịch sodium hydrogen nóng tạo thành sodium chlorine, sodium chlorate và nước
Lập phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử
Phương pháp giải:
- Phương pháp thăng bằng electron:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử các nguyên tố ở 2 vế
Lời giải:
- Xác định nguyên tử có sự thay đổi số oxi hóa
Cl20+ NaOH→NaCl−1+ NaCl+1O + H2O

- Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ, tính ra hệ số của các chất khác
Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu hỏi 8 trang 110 Hóa học 10: Viết phương trình hóa học minh họa tính oxi hóa giảm dần trong dãy Cl2, Br2, I2
Phương pháp giải:
- Cl2 tác dụng với NaBr, NaI
- Br2 tác dụng với NaI
Lời giải:
Cl2 + NaBr → NaCl + Br2 => Cl2 có tính oxi hóa mạnh hơn Br2
Cl2 + NaI → NaCl + I2 => Cl2 có tính oxi hóa mạnh hơn I2
Br2 + NaI → NaBr + I2 => Br2 có tính oxi hóa mạnh hơn I2
=> Tính oxi hóa giảm dần trong dãy Cl2, Br2, I2
V. Điều chế chlorine
Câu hỏi 9 trang 111 Hóa học 10: Khi sản xuất chlorine trong công nghiệp, NaOH và H2 được tạo thành ở cực âm, còn Cl2 được tạo thành từ cực dương. Tại sao cần sử dụng màng ngăn xốp để ngăn cách 2 điện cực?
Phương pháp giải:
Cl2 tác dụng với NaOH
Lời giải:
- Trong công nghiệp người ta điều chế Cl2 bằng cách điện phân dung dịch NaCl có màng ngăn
- Mục đích của màng ngăn là để tránh Cl2 tiếp xúc phản ứng với dung dịch NaOH tạo nước Gia – ven:
Cl2 + 2NaOH → NaCl + NaClO + H2O
>>> Bài tiếp theo: Giải Hóa học 10 Kết nối tri thức bài 22
Như vậy, VnDoc.com đã gửi tới các bạn Giải Hóa học 10 bài 21: Nhóm halogen. Ngoài ra, các em học sinh có thể tham khảo môn Ngữ văn 10 Kết nối tri thức tập 1, Vật Lý 10 Kết nối tri thức và Toán 10 Kết nối tri thức tập 1, Toán 10 Kết nối tri thức tập 2, Sinh 10 Kết nối tri thức đầy đủ khác.









