Khí SO2 màu gì? Khí SO2 có mùi gì?
VnDoc xin giới thiệu bài Khí SO2 màu gì? Khí SO2 có mùi gì? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Khí SO2 màu gì?
Câu hỏi: Khí SO2 màu gì? khí SO2 có mùi gì?
Trả lời:
Lưu huỳnh đioxit hay là Khí Sunfurơ chất khí không màu, mùi hắc, nặng hơn hai lần không khí, hoá lỏng ở -10°C.
I. Cấu tạo của SO2
- Do nguyên tử S ở trạng thái kích thích có 4 e độc thân → những e độc thân này của nguyên tử S sẽ kết hợp với 4 e độc thân của 2 nguyên tử O → tạo 4 liên kết cộng hóa trị có cực.
=> Công thức cấu tạo:
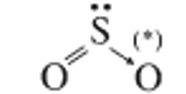
- Trong SO2: S có số oxi hóa +4.
II. Tính chất vật lí của SO2
- Trạng thái: là chất khí, không màu, mùi hắc, nặng hơn không khí khoảng 2 lần.
- Nhiệt độ hóa lỏng: -10oC.
- Tan nhiều trong nước.
- Là khí độc → hít thở gây viêm đường hô hấp.
Lưu huỳnh đioxit mang đầy đủ tính chất hóa học của một oxit axit.
III. Tính chất hóa học của SO2
- Tác dụng với nước tạo thành dung dịch axit.
Ví dụ: SO2 + H2O → H2SO3
- Tác dụng với dung dịch bazơ tạo thành muối và nước.
Ví dụ: SO2 + 2NaOH → Na2SO3 + H2O
- Tác dụng với oxit bazơ tạo thành muối.
Ví dụ: SO2 + Na2O → Na2SO3
IV. Điều chế
- Đốt cháy lưu huỳnh:
S + O2 → SO2 (t0)
- Đốt cháy H2S trong oxi dư:
2H2S + 3O2 → 2H2O + 2SO2
- Cho kim loại tác dụng với H2SO4 đặc nóng:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Đốt quặng firit sắt:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
- Trong phòng thí nghiệm dùng phản ứng của Na2SO3 với dung dịch H2SO4:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
V. Tác hại
- Lưu huỳnh dioxide là một trong những chất gây ô nhiễm môi trường. Nó sinh ra như là sản phẩm phụ trong quá trình đốt cháy than đá, dầu, khí đốt.
- Nó là một trong những chất gây ra mưa axít ăn mòn các công trình, phá hoại cây cối, biến đất đai thành hoang mạc.
- Khí SO2 gây bệnh cho người như viêm phổi, đau mắt,viêm đường hô hấp...
VI. Ứng dụng của lưu huỳnh đioxit
- Dùng trong sản xuất hợp chất Axit Sunfuric
- Sử dụng làm chất tẩy trắng bột giấy và dung dịch đường
- Ứng dụng trong làm chất bảo quản cho các loại thực phẩm sấy khô
- Trong ngành sản xuất rượu
- Trong phòng thí nghiệm: sử dụng làm thuốc thử để nhận biết các chất khác và được dùng như một dung môi trơ
VII. Bài tập ví dụ
Ví dụ 1: Hấp thụ 3,36 lít khí SO2 (đktc) vào 200 ml dung dịch NaOH aM. Tính a biết sau phản ứng chỉ thu được muối trung hòa.
Hướng dẫn:
Vì đề cho chỉ tạo muối trung hòa nên chỉ xảy ra phản ứng
SO2 + 2NaOH → Na2SO3 + H2O
0,15 → 0,3
nSO2 = 0,15 mol , VNaOH = 200 ml = 0,2 lít
→ a = CMNaOH = 0,15/0,2 = 0,75M
Ví dụ 2: Hấp thụ 6,72 lít khí SO2 (đktc) vào 100 ml dung dịch Ba(OH)2 2M. Tính khối lượng muối thu được
Hướng dẫn:
Cách 1:
Ba(OH)2 + SO2 → BaSO3↓ + H2O
x mol → x mol → x mol
BaSO3 + SO2dư + H2O → Ba(HSO3)2
x mol → x mol
tạo kết tủa, khi dư SO2, kết tủa bị hòa tan, để hòa tan hết kết tủa nSO2 ít nhất = 2x= 2nBa(OH)2
Nếu lượng SO2 không đủ để hòa tan hết kết tủa, thì kết tủa chỉ bị tan một phần tức tồn tại 2 muối BaSO3 và Ba(HSO3)2
Ba(OH)2 + SO2 → BaSO3↓ + H2O
0,2 → 0,2 0,2
BaSO3 + SO2dư + H2O → Ba(HSO3)2
0,1 ← (0,3-0,2) → 0,1
nBaSO3 còn lại = 0,2 – 0,1 = 0,1 mol
Cách 2: Nhẩm trắc nghiệm: để hòa tan hết kết tủa nSO2 = 2nBa(OH)2 , nếu lượng kết tủa chỉ bị tan một phần
nSO2 = 2nBa(OH)2 - nkết tủa (vì tỉ lệ số mol hòa tan kết tủa là 1:1)
→ nBaSO3 còn lại = 2nBa(OH)2 - nSO2 = 2.0,2 – 0,3 = 0,1 mol
Số mol 2 muối = số mol Ba(OH)2 → nBa(HSO3)2= nBa(OH)2 - nBaSO3 còn lại = 0,2 – 0,1 = 0,1 mol
→ mBaSO3 = 0,1 . 217 = 12,7g
mBa(HSO3)2 = 0,1.299 = 29,9g
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Khí SO2 màu gì? Khí SO2 có mùi gì? Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.










