Giải Hóa 10 Bài 13: Liên kết cộng hóa trị
Giải bài tập Hoá 10: Liên kết cộng hóa trị tóm tắt lại các kiến thức cơ bản, giúp các em nhanh chóng nắm bắt kiến thức bài học. Đồng thời, lời giải hay bài tập hóa học 10 này còn hướng dẫn giải chi tiết các bài tập trong sách giáo khoa, từ đó bạn đọc nắm được phương pháp, cách giải nội dung từ câu hỏi bài tập, hi vọng sẽ giúp các em học tốt môn Hóa học 10.
Giải bài tập Hóa 10 trang 64 Liên kết cộng hóa trị
A. Nội dung SGK Hóa 10 mới
Theo nội dung chương trình lớp 10 mới, tùy vào khu vực cũng như trường học để chọn bộ sách giáo khoa mới phù hợp với học sinh trong 3 bộ sách là: Kết nối tri thức và cuộc sống, Cánh diều, Chân trời sáng tạo. Dưới đây mời các bạn tham khảo chi tiết nội dung bài học sách mới có liên quan:
- Giải Hóa 10 Bài 10: Liên kết cộng hóa trị - Sách Chân trời sáng tạo
- Giải Hóa 10 Bài 12: Liên kết cộng hóa trị - Sách Kết nối tri thức
- Giải Hóa 10 Bài 11: Liên kết cộng hóa trị Cánh diều
B. Lý thuyết về liên kết cộng hóa trị
1. Liên kết cộng hóa trị
a) Tuy nhiên, sự hình thành liên kết trong phân tử giữa những nguyên tử của các nguyên tố có bản chất hóa học giống nhau hoặc tương tự nhau thì không thể giải thích sự hình thành liên kết trong phân tử bằng lí thuyết nhường và thu electron ở lớp ngoài cùng như kiểu hình thành liên kết ion. Để giải thích sự hình thành liên kết trong phân tử các loại này người ta phải giải thích bằng liên kết cộng hóa trị.
Sự tạo thành liên kết cộng hóa trị trong phân tử đơn chất
Liên kết được tạo thành giữa hai nguyên tử bằng cách góp electron để đạt cấu hình 8 electron giống khí hiếm gần nhất.
Thí dụ:
Trong phân tử Cl2, mỗi nguyên tử Clo đạt được cấu hình 8 electron giống khí hiếm Ar bằng cách mỗi nguyên tử góp 1 electron tạo thành electron chung
Công thức cấu tạo: Cl - Cl
Các phân tử H2, O2, N2, Cl2... tạo nên từ hai nguyên tử của cùng một nguyên tố (có độ âm điện như nhau) nên cặp electron chung không bị lệch về phía nguyên tử nào. Đó là liên kết cộng hóa trị không cực.
b) Sự tạo thành liên kết cộng hóa trị trong phân tử hợp chất
Thí dụ: Phân tử hiđro clorua HCl.
Trong phân tử hiđro, mỗi nguyển tử (H và Cl) góp 1 electron tạo thành một cặp electron chung để tạo liên kết cộng hóa trị. Cặp electron liên kết bị lệch về phía Clo, (độ âm điện của Cl là 3,5 lớn hơn độ âm điện của H là 2,1) liên kết cộng hóa trị này bị phân cực.
Công thức cấu tạo: H – Cl
c) Định nghĩa liên kết cộng hóa trị
Liên kết cộng hóa trị là liên kết được hình thành bằng một hay nhiều cặp electron chung.
d) Hóa trị trong hợp chất cộng hóa trị
Hóa trị của một nguyên tố trtong hợp chất cộng hóa trị gọi là cộng hóa trị và bằng số liên kết mà nguyên tử nguyên tố đó tạo ra được với các nguyên tử khác trong phân tử.
2. Hiệu độ âm điện và liên kết hóa học
|
Hiệu số độ âm điện |
0,0 → < 0,4 |
0,4 → < 1,7 |
≥ 1,7 |
|
Loại liên kết |
Cộng hóa trị không cực |
Cộng hóa trị có cực |
Ion |
C. Giải bài tập SGK Hóa 10 trang 64
Bài 1 trang 64 SGK Hóa 10
Chọn câu đúng nhất về liên kết cộng hóa trị.
Liên kết cộng hóa trị là liên kết:
A. Giữa các phi kim với nhau.
B. Trong đó cặp electron chung bị lệch về một nguyên tử.
C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
D. Được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
Hướng dẫn giải bài tập
Đáp án: D
Bài 2 trang 64 SGK Hóa 10
Chọn câu đúng trong các câu sau:
A. Trong liên kết cộng hóa trị, cặp electron lệch về phía nguyên tử có độ âm điện nhỏ hơn.
B. Liên kết cộng hóa trị có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
C. Liên kết cộng hóa trị không có cực được tạo nên từ các nguyên tử khác hẳn nhau về tính chất hóa học.
D. Hiệu độ âm điện giữa 2 nguyên tử lớn thì phân tử phân cực yếu.
Hướng dẫn giải bài tập
Đáp án: B Liên kết cộng hóa trị có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
Bài 3 trang 64 SGK Hóa 10
Độ âm điện của một nguyên tử đặc trưng cho:
A. Khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
B. Khả năng nhường electron của nguyên tử đó cho nguyên tử khác.
C. Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
D. Khả năng nhường proton của nguyên tử đó cho nguyên tử khác.
Hướng dẫn giải bài tập
Đáp án: A
Bài 4 trang 64 SGK Hóa 10
Thế nào là liên kết ion, liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực? Cho thí dụ minh họa.
Hướng dẫn giải bài tập
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Thí dụ: K+ + Cl- → KCl
Liên kết cộng hóa trị không cực là liên kết được tạo nên giữa hai nguyên tử bằng những cặp electron chung.
Thí dụ: ![]()
Liên kết cộng hóa trị trong đó những cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực.
Thí dụ: ![]()
Bài 5 trang 64 SGK Hóa 10
Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nào trong các chất sau đây: AlCl3, CaCl2, CaS, Al2S3?
Lấy giá trị độ âm điện của các nguyên tố ở bảng 6 trang 45
Hướng dẫn giải bài tập
Hiệu dộ âm điện CaCl2: 2,16 → Liên kết ion.
Hiệu độ âm điện AlCl3, CaS, Al2S3 lần lượt là: 1,55; 1,58; 0,97 -> Liên kết cộng hóa trị có cực.
Bài 6 trang 64 SGK Hóa 10
Viết công thức electron và công thức cấu tạo các phân tử sau: Cl2, CH4, C2H4, C2H2, NH3.
Hướng dẫn giải bài tập
Công thức electron và công thức cấu tạo của các phân tử sau:
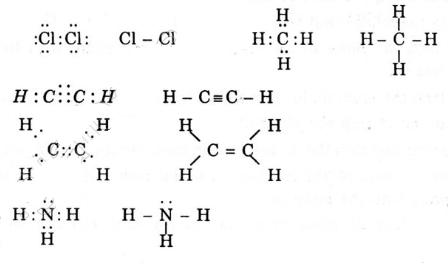
Bài 7 trang 64 SGK Hóa 10
X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
Hướng dẫn giải bài tập
a) 9X: 1s2 2s2 2p5: Đây là F có độ âm điện là 3,98.
19A: 1s2 2s2 2p6 3s2 3p6 4s1: Đây là K có độ âm điện là 0,82.
8Z: 1s2 2s2 2p4: Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16, có liên kết ion.
Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực.
>> Mời các bạn tham khảo thêm một số tài liệu liên quan đến giải hóa 10 bài tiếp theo tại: Giải Hóa 10 bài 14: Tinh thể nguyên tử và tinh thể phân tử
D. Giải sách bài tập hóa 10 bài 14: Tinh thể nguyên tử và tinh thể phân tử
Ngoài các dạng câu hỏi bài tập sách giáo khoa hóa 10 bài 14, để củng cố nâng cao kiến thức bài học cũng như rèn luyện các thao tác kĩ năng làm bài tập. Các bạn học sinh cần bổ sung làm thêm các câu hỏi bài tập sách bài tập. Để hỗ trợ bạn đọc trong quá trình học tập cũng như làm bài tập. VnDoc đã hướng dẫn các ban học sinh giải các dạng bài tập trong Sách bài tập Hóa 8 bài 14 tại:
......................................
>> Mời các bạn tham khảo thêm một số tài liệu liên quan:
- Giải Hóa 10 Bài 11: Luyện tập bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học
- Giải bài tập trang 59, 60 SGK Hóa học lớp 10: Liên kết ion - Tinh thể ion
- Giải bài tập trang 70, 71 SGK Hóa học lớp 10: Tinh thể nguyên tử và tinh thể phân tử
Trên đây VnDoc đã giới thiệu Giải Hóa 10 Bài 13: Liên kết cộng hóa trị. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THPT miễn phí trên Facebook, mời bạn đọc tham gia nhóm Tài liệu học tập lớp 10 để có thể cập nhật thêm nhiều tài liệu mới nhất.









