Nhận xét về độ âm điện của các halogen?
Nhận xét về độ âm điện của các halogen? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Độ âm điện của các halogen
Câu hỏi: Nhận xét về độ âm điện của các halogen? Độ âm điện biến đổi như thế nào khi đi từ Flo đến Iot?
Trả lời:
- Các halogen có độ âm điện tương đối lớn, trong đó F có độ âm điện lớn nhất (3,98).
- Độ âm điện giảm dần từ F đến I.
|
Nguyên tố |
F |
Cl |
Br |
I |
|
Độ âm điện |
3,98 |
3,16 |
2,96 |
2,66 |
- Trong hợp chất:
+ F có độ âm điện lớn nhất nên chỉ có số oxi hóa −1.
+ Các nguyên tố halogen khác, ngoài số oxi hóa −1 còn có các số oxi hóa +1, +3, +5, +7.
1. Độ âm điện là gì?
Độ âm điện của một nguyên tử là khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học. Như vậy độ âm điện của nguyên tử nguyên tố càng lớn thì tính phi kim nguyên tố đó càng mạnh, tính kim loại càng yếu và ngược lại.
Độ âm điện của một nguyên tố đặc trưng cho khả năng hút electron của nguyên tử nguyên tố đó trong phân tử (những electron bị hút là những electron nằm trong liên kết giữa các nguyên tử trong phân tử).
Trong hóa học có nhiều thang độ âm điện khác nhau, tuy nhiên phổ biến hơn cả là thang độ âm điện Pauling do nhà hóa học Linus Pauling thiết lập năm 1932.
Độ âm điện ảnh hưởng đến electron trong liên kết như thế nào? Khi hai nguyên tử có chung cặp electron trong liên kết, sự chia sẻ này không luôn luôn cân bằng. Khi một nguyên tử có độ âm điện cao hơn nguyên tử còn lại, nó sẽ kéo hai electron trong liên kết về gần nó hơn. Nguyên tử có độ âm điện rất cao có thể kéo các electron về phía nó gần như hoàn toàn, và hầu như không chia sẻ các electron với nguyên tử còn lại.
Ví dụ, trong phân tử NaCl (natri clorua), nguyên tử clo có độ âm điện tương đối cao và nguyên tử natri có độ âm điện tương đối thấp. Do đó các electron bị kéo về phía nguyên tử clo và cách xa nguyên tử natri.
2. Bảng độ âm điện của các nguyên tố hóa học
Bảng độ âm điện của Pau-ling lấy nguyên tử flo làm chuẩn để xác định độ âm điện tương đối của các nguyên tử nguyên tố khác.
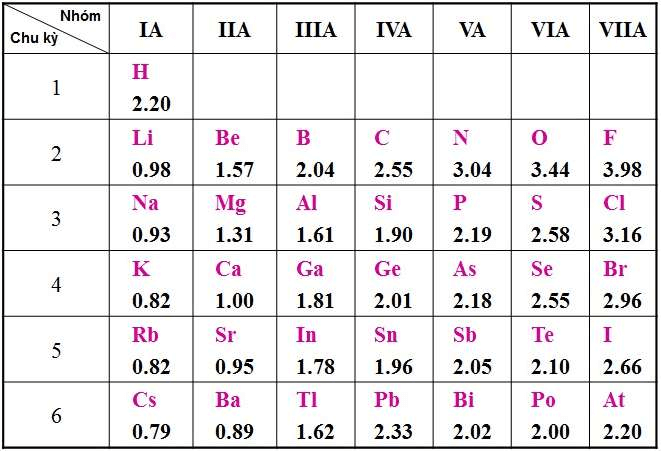
Nhận xét:
+ Trong một chu kì, độ âm điện của các nguyên tử tăng dần từ trái qua phải theo chiều điện tích hạt nhân.
+ Trong một nhóm, độ âm điện của các nguyên tử giảm dần từ trên xuống dưới theo chiều điện tích hạt nhân.
3. Sự biến đổi độ âm điện
Trong một chu kì theo chiều tăng dần của điện tích hạt nhân (từ trái qua phải), độ âm điện của nguyên tử các nguyên tố thường tăng dần.
Trong cùng một nhóm (từ trên xuống dưới) theo chiều tăng của điện tích hạt nhân, độ âm điện của nguyên tử các nguyên tố thường giảm dần.
Độ âm điện của phi kim lớn hơn so với của kim loại
Vậy độ âm điện của nguyên tử nguyên tố A biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
4. Độ âm điện của halogen
Độ âm điện của flo: 3,98
Độ âm điện của clo: 3,16
Độ âm điện của brom: 2,96
Độ âm điện của i ốt: 2,66
Độ âm điện của flo là cao nhất trong nhóm halogen. Độ âm điện giảm dần theo chiều clo -> brom -> i ốt.
5. Bài tập về độ âm điện
Bài 1. Các nguyên tố của chu kì 2 được sắp xếp theo chiều giá trị độ âm điện giảm dần (từ trái sang phải) như sau:
- F, O, N, C, B, Be, Li.
- Li, B, Be, N, C, F, O.
- Be, Li, C, B, O, N, F.
- N, O, F, Li, Be, B, C.
Giải:
Chỉ cần nhớ độ âm điện của flo là lớn nhất, từ đó chọn đáp án A
Bài 2. Nguyên tử nào trong bảng tuần hoàn có giá trị độ âm điện lớn nhất? Tại sao?
Giải:
Nguyên tử của nguyên tố flo có độ âm điện lớn nhất. Bởi vì tính phi kim của flo là mạnh nhất trong tất cả các nguyên tử nguyên tố trong bảng tuần hoàn.
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Nhận xét về độ âm điện của các halogen? Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.









