HCl là axit mạnh hay yếu
HCl là axit mạnh hay yếu được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
HCl là axit mạnh hay yếu
- HCl là một axit vô cơ mạnh, được tạo ra từ sự hòa tan trong nước của khí hydro clorua (HCl). Do vậy, nó mang đầy đủ tính chất hóa học của 1 axit mạnh
1. Giới thiệu chung về axit clohidric HCl
- Axit clohidric là một axit vô cơ mạnh được tạo thành từ 1 nguyên tử hidro và 1 nguyên tử clo, tạo ra từ sự hòa tan của khí hydro clorua (HCl) trong nước
- Hidro clorua HCl, là một chất khí không màu, mùi xốc, độc và nặng hơn không khí, tạo thành khói trắng khi tiếp xúc với hơi ẩm
- Axit clohđric HCl là chất lỏng không màu, thường lẫn clo hòa tan nên có màu vàng nhạt, dễ bay hơi, có tính ăn mòn cao . Dung dịch axit HCl không màu, HCl đậm đặc có nồng độ cao nhất là 40%, bốc khói trong không khí ẩm.
- Các tính chất vật lý của axit clohiđric như điểm sôi và điểm nóng chảy, mật độ, và pH phụ thuộc vào nồng độ mol của HCl trong dung dịch axit.
HCl là chất điện ly mạnh
- HCl có thể tan hoàn toàn trong nước và phân ly cho ra một ion H+ và một ion Cl−. Trong quá trình hòa tan trong nước, ion H+ liên kết với H2O tạo thành ion H3O+. Phương trình:
HCl + H2O → H3O+ + Cl–
2. Tính chất vật lí
- Hiđro clorua (HCl) tan vào nước tạo thành dung dịch Axit Clohidric (HCl).
- Axit HCl là chất lỏng không màu, dễ bay hơi. Dung dịch axit HCl không màu, HCl đặc bốc khói trong không khí ẩm.
3. Tính chất hóa học
- Dung dịch HCl có đầy đủ tính chất của một axit mạnh
Làm quỳ tím chuyển thành màu đỏ.
Tác dụng với kim loại
- Những kim loại tác dụng với HCl là các kim loại đứng trước Hidro trong bảng tuần hoàn như Fe, Al, Mg. Phản ứng tạo ra muối clorua và giải phóng khí Hidro. Phương trình phản ứng như sau:
2HCl + Mg → MgCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
6HCl + 2Al → 2AlCl3 + 3H2↑
Tác dụng với oxit kim loại
- HCl có khả năng tác dụng với các oxit kim loại như Al2O3, CuO, Fe3O4 tạo ra muối và nước. Phương trình phản ứng như sau:
Fe3O4 + 8HCl → 4H2O + FeCl2+ 2FeCl3
6HCl + Al2O3 →2AlCl3 + 3H2O
2HCl + CuO → CuCl2 + H2O
Tác dụng với muối
- Axit clohidric còn có thể tác dụng với muối, tạo ra muối mới và axit mới. Điều kiện để phản ứng xảy ra là axit tạo ra phải yếu hơn HCl, sản phẩm có kết tủa hoặc tạo ra chất khí bay lên. Phương trình phản ứng như sau:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + 2HCl → AgCl↓ + HNO3
2HCl + BaS → BaCl2 + H2S↑
K2CO3 + 2HCl → 2KCl + H2O + CO2↑
Tác dụng với bazơ
- HCl tác dụng với bazo tạo ra muối và nước. Phương trình phản ứng như sau:
2HCl + 2NaOH → 2NaCl + H2O
2HCl + Ca(OH)2 → CaCl2 + 2H2O
2HCl + Fe(OH)2 → FeCl2 + 2H2O
Tác dụng với hợp chất có tính oxi hóa
- Bên cạnh khả năng oxi hóa khi phản ứng với các kim loại đứng trước Hidro, Acid HCl còn có thể tác dụng với các chất có tính oxy hóa mạnh như KMnO4, K2Cr2O7, MnO2, KClO3, … Trong phản ứng này, nó giữ vai trò là một chất có tính khử mạnh. Phương trình phản ứng:
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
2HCl + MnO2 → MnCl2 + Cl2↑ + H2O
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
4. HCl không tác dụng với chất nào?
Bên cạnh những hợp chất tác dụng được với HCl mà Bilico đã chia sẻ ở phía trên, dưới đây là một số chất không tác dụng được:
- Kim loại đứng sau Hidro trong dãy điện hóa: Cu. Ag, Au,….
- Muối không tan: Các muối có gốc CO3 và PO4 nhưng trừ K2CO3 và Na2CO3, K3PO4 và Na3PO4)
- Axit: Không tác dụng với tất cả các axit
- Phi kim: Không tác dụng được với phi kim
- Oxit kim loại: Không tác dụng được với oxit kim loại
- Oxit phi kim: Không tác dụng được với oxit phi kim
5. Điều chế
Trong phòng thí nghiệm (phương pháp sunfat): cho NaCl tinh thể vào dung dịch H2SO4 đậm đặc
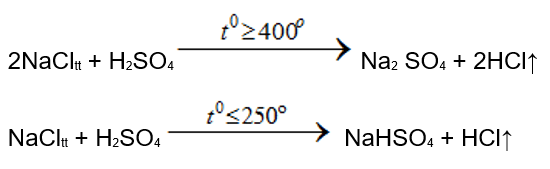
Trong công nghiệp (phương pháp tổng hợp): đốt hỗn hợp khí hidro và khí clo
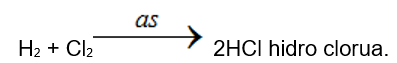
6. Ứng dụng của axit clohidric
Axit clohidric được ứng dụng trong rất nhiều ngành công nghiệp:
- Tẩy gỉ thép.
- Sản xuất các hợp chất hữu cơ.
- Sản xuất các hợp chất vô cơ chứa clo.
- Kiểm soát và trung hòa pH (điều chỉnh pH của nước).
- Tái sinh các nhựa trao đổi ion (rửa các cation từ các loại nhựa).
- Xử lý da, vệ sinh và xây dựng nhà cửa.
- Sản xuất thực phẩm, các thành phần thực phẩm và phụ gia thực phẩm.
- Công nghiệp khoan, công nghiệp khai thác dầu.
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài HCl là axit mạnh hay yếu. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.










