Viết các phương trình hóa học chứng minh Clo vừa có tính oxi hóa
Viết các phương trình hóa học chứng minh Clo vừa có tính oxi hóa được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Chứng minh clo vừa có tính oxi hóa vừa có tính khử
Câu hỏi: Viết các phương trình hóa học chứng minh clo vừa có tính oxi hóa vừa có tính khử?
Trả lời:
Các phương trình hóa học chứng minh clo vừa có tính oxi hóa vừa có tính khử:
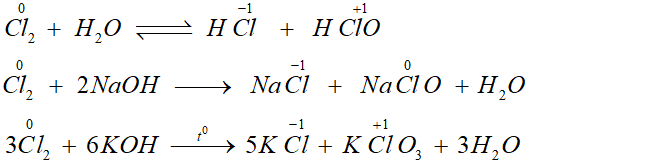
1. Phương trình hóa học là gì?
Phương trình hóa học (hay Phương trình biểu diễn phản ứng hóa học) là một phương trình gồm có hai vế nối với nhau bởi dấu mũi tên từ trái sang phải, vế trái biểu diễn các chất tham gia phản ứng, vế phải biểu diễn các chất thu được sau phản ứng, tất cả các chất đều được viết bằng công thức hóa học của chúng và có những hệ số phù hợp đặt trước công thức hoá học đó để bảo đảm đúng định luật bảo toàn khối lượng. Phương trình hóa học được viết ra đầu tiên bởi Jean Beguin vào năm 1615.
Căn cứ vào phương trình hóa học bạn có thể nhận biết được tỉ lệ về số nguyên tử, phân tử của các chất, cặp chất tham gia vào một phản ứng hóa học.
Để lập một phương trình hóa học cần phải tuân theo các bước sau:
+ Bước 1: Viết sơ đồ phản ứng
+ Bước 2: Cân bằng phương trình hóa học
+ Bước 3: Hoàn thành phương trình hóa học
Ví dụ: Phản ứng của Hidro với Oxi tạo thành nước sẽ có phương trình như sau
H2 + O2 = H2O
2. Bài tập minh họa
Bài 1: Hãy lập những phương trình hóa học theo những sơ đồ sau:
Fe2O3 + CO → CO2 + Fe.
Fe3O4 + H2 → H2O + Fe.
CO2 + 2Mg → 2MgO + C.
– Những phản quang hóa học này có cần là phản quang oxi hóa – khử không? Vì sao? Nếu là phản quang oxi hóa – khử cho biết chất nào là chất khử, chất oxi hóa? Vì sao?
Lời giải
Fe2O3 + 3CO → 3CO2 + 2Fe.
Fe3O4 + 4H2 → 4H2O + 3Fe.
CO2 + 2Mg → 2MgO + C.
– Cả 3 phản quang đều là phản quang oxi hóa – khử.
– Những chất khử là CO, H2, Mg vì đều là chất chiếm oxi.
– Những chất oxi hóa là Fe2O3, Fe3O4, CO2vì đều là chất nhường oxi.
Bài 2: Trong phòng thí nghiệm người ta đã sử dụng cacbon oxit CO để khử 0,2 mol Fe 3 O 4 and sử dụng khí hiđro để khử 0,2 mol Fe 2 O 3 ở nhiệt đ ộ cao.
a) Viết phương trình hóa học của những phản quang đã xảy ra.
b) Tính số lít khí ở đktc CO and H2 cần sử dụng cho mỗi phản quang.
c) Tính số gam sắt thu đc ở mỗi phản quang hóa học.
Lời giải
a) Phương trình hóa học của những phản quang:
4CO + Fe3O4 → 3Fe + 4 CO2 (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b) Theo phương trình phản quang trên ta có:
– Muốn khử 1 mol Fe3O4 cần 4 mol CO.
⇒ Muốn khử 0,2 mol Fe3O4 cần x mol CO.
⇒ x= 0,2.4 = 0,8 (mol) CO.
⇒ VCO = n.22,4 = 0,8.22,4 = 17,92 (lít).
– Muốn khử 1 mol Fe2O3 cần 3 mol H2.
⇒ Muốn khử 0,2 mol Fe2O3 cần y mol H2.
⇒ y = 0,2.3 = 0,6 mol.
⇒ VH2= n.22,4 = 0,6.22,4 = 13,44 (lít).
c) Ở phản quang (1) khử 1 mol Fe3O4 đc 3 mol Fe.
– Vậy khử 0,2 mol Fe3O4 đc 0,2.3=0,6 mol Fe.
⇒ mFe = n.M = 0,6.56 = 33,6g Fe.
Ở phản quang (2) khử 1 mol Fe2O3 đc 2 mol Fe.
Vậy khử 0,2 mol Fe2O3 đc 0,4 mol Fe.
mFe = n.M = 0,4 .56 = 22,4g Fe.
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Viết các phương trình hóa học chứng minh Clo vừa có tính oxi hóa. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.









