Các dạng bài tập môn Hóa học lớp 10
Các dạng bài tập môn Hóa học lớp 10
Các dạng bài tập môn Hóa học lớp 10 gồm các dạng bài tập của 6 chương của môn Hóa lớp 10 là tài liệu hữu ích dành cho các bạn học sinh lớp 10 trong việc ôn tập và củng cố các kiến thức đã học môn Hóa học.
Tài liệu giải bài tập môn Hóa lớp 10 này giúp các bạn học sinh hệ thống lại các vấn đề các phản ứng hóa học, nguyên tử... Các bài tập có đáp án đi kèm sẽ giúp các bạn ôn tập hiệu quả hơn. Mời các bạn tải về để tham khảo.
CHƯƠNG 1: NGUYÊN TỬ
A. BÀI TẬP CÓ LỜI GIẢI
1.1. Vì sao từ những ý tưởng đầu tiên về nguyên tử, cách đây 2500 năm của Democrit, mãi đến cuối thế kỉ XIX người ta mới chúng minh được nguyên tử là có thật và có cấu tạo phức tạp? Mô tả thí nghiệm tìm ra electron.
1.2. Nguyên tử khối của neon là 20,179. Hãy tính khối lượng của một nguyên tử neon theo kg.
1.3. Kết quả phân tích cho thấy trong phân tử khí CO2 có 27,3% C và 72,7% O theo khối lượng. Biết nguyên tử khối của C là 12,011. Hãy xác định nguyên tử khối của oxi.
1.4. Biết rằng khối lượng một nguyên tử oxi nặng gấp 15,842 lần và khối lượng của nguyên tử cacbon nặng gấp 11,9059 lần khối lượng của nguyên tử hiđro. Hỏi nếu chọn 1/12 khối lượng nguyên tử cacbon làm đơn vị thì H, O có nguyên tử khối là bao nhiêu?
1.5. Mục đích thí nghiệm của Rơ-dơ-pho là gì? Trình bày thí nghiệm tìm ra hạt nhân nguyên tử của Rơ-dơ-pho và các cộng sự của ông.
1.6. Hãy cho biết số đơn vị điện tích hạt nhân, số proton, số nơtron và số electron của các nguyên tử có kí hiệu sau đây: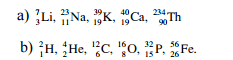
1.7. Cách tính số khối của hạt nhân như thế nào ? Nói số khối bằng nguyên tử khối thì có đúng không? tại sao?
1.8. Nguyên tử khối trung bình của bạc bằng 107,02 lần nguyên tử khối của hiđro. Nguyên tử khối của hiđro bằng 1,0079. Tính nguyên tử khối của bạc.

a) Tính nguyên tử khối trung bình của mỗi nguyên tố.
b) Có thể có bao nhiêu loại phân tử HCl khác nhau được tạo nên từ hai loại đồng vị của hai nguyên tố đó.
c) Tính phân tử khối gần đúng của mỗi loại phân tử nói trên.

a) Viết các công thức phân tử hiđro có thể có.
b) Tính phân tử khối của mỗi loại phân tử.
c) Một lit khí hiđro giàu đơteri ![]() ở điều kiện tiêu chuẩn nặng 0,10g. Tính thành phần % khối lượng từng đồng vị của hiđro.
ở điều kiện tiêu chuẩn nặng 0,10g. Tính thành phần % khối lượng từng đồng vị của hiđro.
1.12. Có thể mô tả sự chuyển động của electron trong nguyên tử bằng các quỹ đạo chuyển động được không? tại sao?
1.13. Theo lí thuyết hiện đại, trạng thái chuyển động của electron trong nguyên tử được mô tả bằng hình ảnh gì?
1.14.Trình bày hình dạng của các obitan nguyên tử s và p và nêu rõ sự định hướng khác nhau của chúng trong không gian.
1.15. Biết rằng nguyên tố agon có ba đồng vị khác nhau, ứng với số khối 36, 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng: 0,34%; 0,06% và 99,6%.
Tính số khối của đồng vị A của nguyên tố agon, biết rằng nguyên tử khối trung bình của agon bằng 39,98.
Phương pháp giải bài tập Hóa học lớp 10
1.1 Hướng dẫn:
Trong một thời kì dài, người ta không có đủ các thiết bị khoa học để kiểm chứng ý tưởng về nguyên tử. Sự phát triển của khoa học và kĩ thuật cuối thế kỉ XIX cho phép chế tạo được thiết bị có độ chân không cao (p = 0,001 mmHg), có màn huỳnh quang để quan sát đường đi của các tia không nhìn thấy bằng mắt thường và nguồn điện có thế hiệu rất cao (15000V).
Thí nghiệm phát minh electron của Tom-xơn (1897)
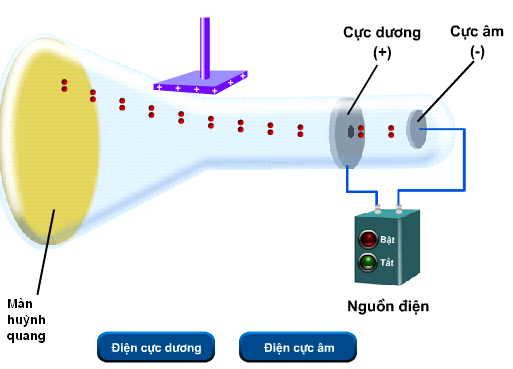
Tom-xơn đã cho phóng điện với thế hiệu 15000 vôn qua hai điện cực gắn vào hai đầu của một ống thủy tinh kín đã rút gần hết không khí, áp suất 0,001 mmHg, thì thấy màn huỳnh quang lóe sáng. Màn huỳnh quang phát sáng do sự xuất hiện của các tia không nhìn thấy được đi từ cực âm sang cực dương, tia này được gọi là tia âm cực. Tia âm cực bị hút lệch về phía cực dương khi đặt ống thủy tinh trong một điện trường. Thí nghiệm này chứng tỏ nguyên tử có cấu tạo phức tạp. Một trong những thành phần cấu tạo của nguyên tử là các electron.
1.2 Hướng dẫn:
Ta có mNe = 1,66005.10-27. 20,179 = 33,498.10-27 kg.
1.3 Hướng dẫn:
Gọi nguyên tử khối của oxi là X, ta có:
( 2X + 12,011).27,3% = 12,011
X = 15,99
1.4 Hướng dẫn: Theo đề bài:

1.5 Hướng dẫn:
Sau thí nghiệm tìm ra electron -loại hạt mang điện tích âm, bằng cách suy luận người ta biết rằng nguyên tử có các phần tử mang điện dương, bởi vì nguyên tử trung hòa điện. Tuy nhiên có một câu hỏi đặt ra là các phần tử mang điện dương phân bố như thế nào trong nguyên tử? Tom-xơn và những người ủng hộ ông cho rằng các phần tử mang điện dương phân tán đều trong toàn bộ thể tích nguyên tử. Trong khi đó Rơ-dơ-pho và các cộng sự muốn kiểm tra lại giả thuyết của Tom-xơn. Họ làm thí nghiệm để tìm hiểu sự phân bố các điện tích dương trong nguyên tử.
Thí nghiệm tìm ra hạt nhân nguyên tử của Rơ-dơ-pho (1911)
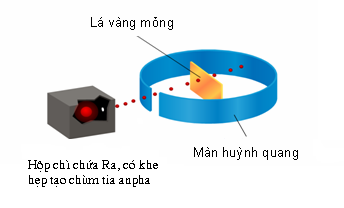
Để kiểm tra giả thuyết của Tom-xơn, Rơ-dơ-pho đã dùng tia bắn phá một lá vàng mỏng, xung quanh đặt màn huỳnh quang để quan sát sự chuyển động của các hạt. Kết quả là hầu hết các hạt đi thẳng, một số ít bị lệch hướng, một số ít hơn bị bật ngược trở lại. Điều này cho phép kết luận giả thuyết của Tom-xơn là sai. Phần mang điện tích dương tập trung ở hạt nhân của nguyên tử, kích thước rất nhỏ bé so với kích thước nguyên tử. Nguyên tử có cấu tạo rỗng.
1.6 Hướng dẫn:
Số đơn vị điện tích hạt nhân, số proton, số nơtron và số electron của các nguyên tử:
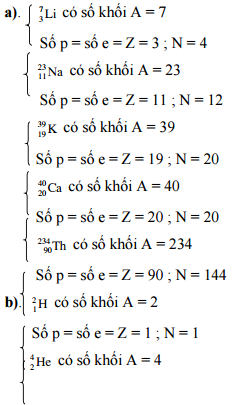
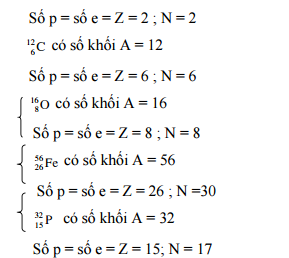
Số p = số e = Z = 15; N = 17
1.7 Hướng dẫn: Cách tính số khối của hạt nhân:
Số khối hạt nhân (kí hiệu A) bằng tổng số proton (p) và số nơtron (n).
A = Z + N
Nói số khối bằng nguyên tử khối là sai, vì số khối là tổng số proton và notron trong hạt nhân, trong khi nguyên tử khối là khối lượng tương đối của nguyên tử. Nguyên tử khối cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
Do khối lượng của mỗi hạt proton và nơtron ~1u, cho nên trong các tính toán không cần độ chính xác cao, coi số khối bằng nguyên tử khối.
1.8 Hướng dẫn:
Ta có AAg = 107,02.AH2 mà AH2= MH2 = 1,0079
AAg = 107,02 . 1,0079 = 107,865


1.12 Hướng dẫn:
Không thể mô tả được sự chuyển động của electron trong nguyên tử bằng các quỹ đạo chuyển động. Bởi vì trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định nào. Người ta chỉ nói đến khả năng quan sát electron tại một thời điểm nào đó trong không gian của nguyên tử.
1.13 Hướng dẫn:
Theo lý thuyết hiện đại trạng thái chuyển động của electron trong nguyên tử được mô tả bằng hình ảnh được gọi là obitan nguyên tử.
1.14 Hướng dẫn:
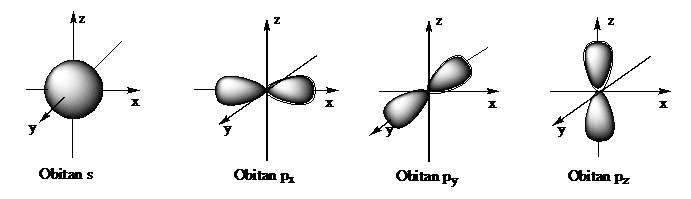
Hình dạng của các obitan nguyên tử s và p:
- Obitan s: Có dạng hình cầu, tâm là hạt nhân nguyên tử. Obitan s không có sự định hướng trong không gian của nguyên tử.
- Obitan p: Gồm ba obitan: px, py và pz có dạng hình số 8 nổi. Mỗi obitan có sự định hướng khác nhau trong không gian. Chẳng hạn: Obitan px định hướng theo trục x, py định hướng theo trục y,...
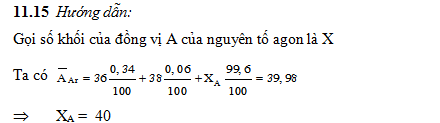
1.16 Hướng dẫn:
Ta có
a) Nguyên tử khối trung bình của Mg là
![]() \({}^{25}Mg\)
\({}^{25}Mg\)
b) Giả sử trong hỗn hợp nói trên có 50 nguyên tử ![]() \({}^{25}Mg\), thì số nguyên tử tương ứng của 2 đồng vị còn lại là:
\({}^{25}Mg\), thì số nguyên tử tương ứng của 2 đồng vị còn lại là:
Số nguyên tử![]() \({}^{24}Mg\) =
\({}^{24}Mg\) = ![]() \(\frac{{50}}{{10,1}}\) x78,6 = 389 (nguyên tử).
\(\frac{{50}}{{10,1}}\) x78,6 = 389 (nguyên tử).
Số nguyên tử ![]() \({}^{26}Mg\)=
\({}^{26}Mg\)= ![]() \(\frac{{50}}{{10,1}}\)x 11,3 = 56 (nguyên tử).
\(\frac{{50}}{{10,1}}\)x 11,3 = 56 (nguyên tử).
1.17 Hướng dẫn:
Ta có
n: 1 2 3 4
Tên lớp: K L M N
Lớp K có một phân lớp 1s
Lớp L có hai phân lớp 2s, 2p
Lớp M có ba phân lớp 3s, 3p, 3d
Lớp N có bốn phân lớp 4s, 4p, 4d, 4f
1.18 Hướng dẫn:
+) Lớp N có: - 4 phân lớp 4s, 4p, 4d, 4f

+) Lớp M có : - 3 phân lớp 3s, 3p, 3d

1.19 Hướng dẫn:
Vẽ hình dạng các obitan 1s, 2s và các obitan 2px, 2py, 2pz
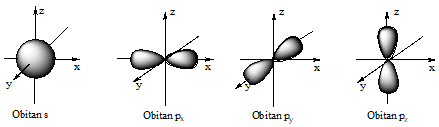
1.20 Hướng dẫn:
Sự phân bố electron trong nguyên tử tuân theo nguyên lý Pau-li, nguyên lý vững bền và quy tắc Hun.
Nguyên lý Pau-li: Trên một obitan chỉ có thể có nhiều nhất là 2 electron và 2 electron này chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
Thí dụ: Nguyên tố He có Z = 2
![]()
Nguyên lý vững bền: ở trạng thái cơ bản trong nguyên tử các electron chiếm lần lượt những obitan có mức năng lượng từ thấp đến cao.
Thí dụ : Nguyên tử B (Z = 5):
![]()
Quy tắc Hun: Trong cùng 1 phân lớp các electron sẽ phân bố trên các obitan sao cho có số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau.
Thí dụ : Nguyên tử C (Z = 6)
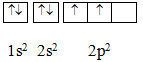
1.21 Hướng dẫn:
Theo nguyên tắc Hun cho nên trong sơ đồ phân bố electron của nguyên tử cacbon ( C: 1s2 2s2 2p2) phân lớp 2p được biểu diễn
1.22 Hướng dẫn:
Cấu hình electron của các nguyên tố có :
Z = 20: 1s2 2s2 2p6 3s2 3p6 4s2
Z = 21: 1s2 2s2 2p6 3s2 3p6 3d1 4s2
Z = 22: 1s2 2s2 2p6 3s2 3p6 3d2 4s2
Z = 24: 1s2 2s2 2p6 3s2 3p6 3d5 4s1
Z = 29: 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Nhận xét:
Cấu hình Z = 20 khác với các cấu hình còn lại ở chỗ không có phân lớp 3d.
Cấu hình Z = 24 và Z = 29 có 1 electron ở phân lớp 4s.
1.23 Hướng dẫn:
Số e ở lớp ngoài cùng của nguyên tử các nguyên tố:
H: có 1e Ca: có 2e O: có 6e
Li: có 1e Mg: có 2e
Na: có 1e C: có 4e
K: có 1e Si: có 4e
1.24 Hướng dẫn:
K (Z= 19): 1s22s22p63s23p64s1
Ca (Z = 20): 1s22s22p63s23p64s2
Vậy sự phân bố electron trên các obitan nguyên tử của các nguyên tố K và Ca có đặc điểm là có 1 hay 2 electron ở lớp ngoài cùng. Những electron này có liên kết yếu với hạt nhân, do đó trong các phản ứng hóa học, K và Ca dễ nhường đi để trở thành các ion dương bền vững.
1.25 Hướng dẫn:
Cấu hình e của F và Cl là:
F (Z = 9) 1s22s22p5
Cl (Z = 17): 1s22s22p63s23p5
Đặc điểm: lớp electron ngoài cùng có 7e, những electron này liên kết chặt chẽ với hạt nhân, do đó trong các phản ứng hóa học, F và Cl có xu hướng nhận thêm 1 electron để đạt cấu hình
bão hòa, bền vững như khí hiếm đứng sau chúng.
1.26 Hướng dẫn: Trật tự theo dãy đã cho là sai, sửa lại là:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 5d 6p 7s 5f 6d ...
Sai ở vị trí của AO 3d và AO 4s.
1.27 Hướng dẫn:
Cấu hình e nguyên tử của các nguyên tố có :
Z = 15: 1s2 2s2 2p6 3s2 3p3
Z = 17: 1s2 2s2 2p6 3s2 3p5
Z = 20: 1s2 2s2 2p6 3s2 3p6 4s2
Z = 21: 1s2 2s2 2p6 3s2 3p6 3d1 4s2
Z = 31: 1s2 2s2 2p6 3s2 3p63d104s2 4p1
1.28 Hướng dẫn:
Fe Z = 26: 1s2 2s2 2p6 3s2 3p63d6 4s2
Fe2+ Z = 26: 1s2 2s2 2p6 3s2 3p63d6
Fe3+ Z = 26: 1s2 2s2 2p6 3s2 3p63d5
.........................
Để tham khảo đầy đủ nội dung tài liệu vui lòng kéo xuống ấn link tải về
VnDoc đã giới thiệu Các dạng bài tập môn Hóa học lớp 10 có hướng dẫn giải, tóm gọn kiến thức nội dụng lí thuyết các chương, từ đó đưa các dạng bài tập và phương pháp giải ở mỗi nội dung. Nội dung câu hỏi lớn đi sâu vào từng dạng bài tập, sẽ là tài liệu tham khảo dành cho các bạn học sinh ôn tập cũng như củng cố lại kiến thức.
Thông qua tài liệu này sẽ giúp các bạn định hướng ôn luyện, làm quen với các dạng bài tập nâng cao kỹ năng giải đề thi.
Trên đây VnDoc đã gửi Đề thi thử vào lớp 10 Chuyên Hóa học năm 2020 tới các bạn. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 9, Chuyên đề Vật Lí 9, Lí thuyết Sinh học 9, Chuyên đề Hóa học. Tài liệu học tập lớp 9 mà VnDoc tổng hợp biên soạn và đăng tải.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Luyện thi lớp 9 lên lớp 10. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.



