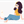Công thức phân tử của Metan
Chúng tôi xin giới thiệu bài Công thức phân tử của Metan được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Công thức phân tử của Metan
Câu hỏi: Công thức phân tử của metan là gì?
Trả lời:
Công thức phân tử metan là:
Khí metan có công thức hóa học là CH4 là một thành phần chính của khí gas mà chúng ta thường dùng. Vậy tính chất hóa học của metan như thế nào, khí metan tác dụng với oxi không? Người ta sản xuất khí metan bằng cách nào, điều chế CH4 trong phòng thí nghiệm và trong công nghiệp khác gì nhau,….
I. Tính chất vật lý và trạng thái tự nhiên của Metan (CH4)
Metan có công thức phân tử là CH4 và phân tử khối bằng 16 đvC.
Trong tự nhiên, metan có nhiều trong:
+ Trong các mỏ khí (khí thiên nhiên)
+ Trong mỏ dầu (khí mỏ hay khí đồng hành)
+ Trong các mỏ than (khí mỏ than)
+ Trong bùn ao (khí bùn ao)
+ Trong khí biogaz…
Metan là chất khí không màu, không mùi, không vị, nhẹ hơn không khí. Tỉ khối của metan với không khí là dCH4/kk = 16/29. Metan rất ít tan trong nước. Nó hóa lỏng ở −162°C, hóa rắn ở −183°C, và rất dễ bắt cháy.
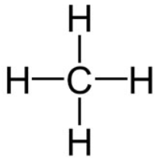
II. Công thức cấu tạo của Metan CH4
- Công thức cấu tạo của Metan CH4:

- Trong công thức cấu tạo của metan chỉ có liên kết đơn.
- Những hiđrocacbon mạch hở, phân tử chỉ có liên kết đơn giống như metan gọi là ankan, có công thức chung CnH2n+2, với n ≥ 1
III. Tính chất hóa học
Tác dụng với oxi:
- Khi đốt trong oxi, metan cháy tạo thành khí CO2 và H2O, tỏa nhiều nhiệt.
![]()
Tác dụng với clo khi có ánh sáng:
- Ở phản ứng này, nguyên tử H của metan được thay thế bởi nguyên tử Cl, vì vậy được gọi là phản ứng thế.
IV. Điều chế
Điều chế CH4 trong công nghiệp
Ở quy mô công nghiệp, cách thu khí CH4 và các đồng đẳng của nó được tách từ khí thiên nhiên và dầu mỏ. Đây là cách điều chế CH4 dễ dàng và nhanh chóng.
Cách điều chế Metan trong phòng thí nghiệm
Một số cách điều chế CH4 trong phòng thí nghiệm như sau:
Khi cần một lượng nhỏ metan, người ta nung natri axetat chung với vôi tôi xút, hoặc điều chế metan bằng cách cho nhôm cacbua tác dụng với nước:
Điều chế CH4 từ nhôm cacbua:
Al4C3+ 12H2O → 4Al(OH)3 + 3CH4
Phản ứng muối natri axetat với xút tạo khí metan (nhiệt phân muối natri của axit carboxylic):
CH3–COONa + NaOH →(CaO, to)Na2CO3 + CH4
Cách điều chế metanol bằng phản ứng cộng hidro vào cacbon:
C + 2H2→(to, Ni) CH4
Cách điều chế CH4 từ khí CO:
CO + 3H2→to H2O+CH4
Hoặc điều chế CH4 bằng cách khử các dẫn xuất methyl của các halogen, ancol hay carbonyl.
V. Ứng dụng của Metan
Sau khi đã tìm hiểu khí metan là gì, cũng như những phản ứng hóa học đặc trưng của nó, chúng ta hãy cùng tìm hiểu về ứng dụng của loại khí này nhé.
+ Như đã nhắc ở trên thì khí metan cháy tỏa nhiều nhiệt, vì vậy CH4 được dùng làm nhiên liệu phổ biến trong đời sống và sản xuất.
+ Metan là nguyên liệu để điều chế khí hiđro hay điều chế axetilen C2H2 từ CH4,…
+ Ngoài ra khí metan còn được sử dụng để điều chế bột than và nhiều chất hóa học khác.
Dù được dùng nhiều nhưng khí metan gây hiệu ứng nhà kính tạo ảnh hưởng đến con người, sinh vật cả động vật và thực vật cũng như môi trường.
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Công thức phân tử của Metan. Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.