Nêu cấu hình electron nguyên tử halogen?
Nêu cấu hình electron nguyên tử halogen? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 10 hiệu quả hơn. Mời các bạn tham khảo.
Cấu hình electron nguyên tử halogen
Câu hỏi: Nêu cấu hình electron nguyên tử halogen? Phân tử halogen có cấu tạo như thế nào?
Trả lời:
- Nguyên tử các nguyên tố halogen đều có 7e lớp ngoài cùng (ns2np5).
- Ở trạng thái tự do, 2 nguyên tử halogen góp chung 1e với nhau tạo 1 liên kết cộng hóa trị không cực.
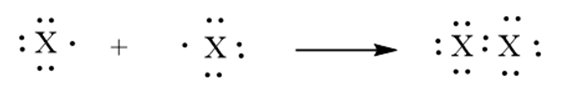
(X là kí hiệu chỉ các nguyên tố halogen)
⟶ Công thức cấu tạo: X−X
⟶ Công thức phân tử: X2
1. Halogen là gì?
Halogen là các nguyên tố phi kim thuộc nhóm VIIA trong bảng tuần hoàn. Các nguyên tố Halogen đứng cuối chu kì, ngay trước các nguyên tố khí hiếm. Như vậy halogen có 7e lớp ngoài cùng.
2. Vị trí của nhóm halogen trong bảng tuần hoàn
Nhóm halogen gồm những nguyên tố nào? Nhóm halogen gồm các nguyên tố flo (F), clo (Cl), brom (Br), iot (I) và atatin (At). Atatin không gặp trong tự nhiên, nó được điều chế nhân tạo trong các lò phản ứng hạt nhân nên được xem xét chủ yếu trong nhóm các nguyên tố phóng xạ.
Những nguyên tố halogen thuộc nhóm VIIA, đứng ở cuối các chu kì và ngay trước các nguyên tố khí hiếm.
3. Cấu tạo phân tử của nhóm halogen
Lớp electron ngoài cùng của nguyên tử các nguyên tố halogen đều có 7 electron, được phân thành hai phân lớp (phân lớp s có 2 electron, phân lớp p có 5 electron).
Do có 7 electron ở lớp ngoài cùng, chỉ còn thiếu 1 electron là đạt được cấu hình electron bền như khí hiếm, nên ở trạng thái tự do, hai nguyên tử halogen góp chung một đôi electron để tạo ra phân tử có liên kết cộng hoá trị không cực.
Liên kết của phân tử (X2) không bền lắm, chúng dễ bị tách thành hai nguyên tử X. Trong phản ứng hóa học, các nguyên tử này dễ thu thêm 1 electron, do đó tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh.
4. Tính chất vật lý
Trong nhóm halogen, tính chất vật lý biến đổi theo quy luật nhất định: từ trạng thái tập hợp, màu sắc, nhiệt độ sôi,... Cụ thể:
- Về trạng thái và màu sắc: chuyển từ khí sang lỏng và rắn với màu sắc đậm dần, Flo ở dạng khí và có màu lục nhạt, Clo trạng thái khí có màu vàng lục, Brom dạng lỏng với màu đỏ nâu và Iốt ở trạng thái rắn có màu đen tím cùng dễ thăng hoa.
- Nhiệt độ nóng chảy cùng nhiệt độ sôi tăng dần từ flo đến iốt.
- Trong nhóm halogen ngoài flo không tan trong nước, các chất còn lại tan tương đối ít và chủ yếu tan nhiều trong một số dung môi hữu cơ.
- Trong tự nhiên chỉ tồn tại ở dạng hợp chất: Clo chủ yếu ở dạng muối clorua, Flo thường ở trong khoáng vật florit và criolit, Brom chủ yếu trong muối bromua củ kali, natri và magie, iốt có trong mô một số loại rong biển và tuyến giáp con người,....
5. Tính chất Hóa học của nhóm Halogen
- Chính bở lớp electron ngoài cùng có 7e nên các nguyên tố Halogen là những phi kim điển hình. Các nguyên tố này rất dễ nhận thêm e để thể hiện tính oxy hóa mạnh.
- Khi đi từ F2 đến I2, tính oxy hóa của nhóm Halogen giảm dần.
- Trong nhóm Halogen chỉ có F có mức oxy hóa -1, các chất còn lại ngoài mức oxy hóa -1 còn có các mức +1, +3, +5, +7.
a, Đơn chất
+ Oxi hóa được nhiều kim loại với xúc tác và nhiệt độ
+ Tác dụng với hidro ở nhiệt độ cao
+ Hầu như không tác dụng với nước
b, hợp chất

Một số phản ứng hóa học minh họa tính chất của Halogen
Tác dụng với kim loại
Các nguyên tố Halogen phản ứng với hầu hết các kim loại trừ Pt và Au (riêng F2 phản ứng được với tất cả các kim loại) tạo ra muối Halogenua. Các phản ứng này thường sẽ xảy ra ở nhiệt độ cao:
2M + nX2 → 2MXn
Muối thu được sẽ ứng với mức hóa trị cao nhất của kim loại. Đặc biệt, phản ứng của Fe với I2 sẽ chỉ tạo ra sản phẩm là FeI2.
Phản ứng với Hidro
Halogen phản ứng với Hidro tạo ra Hidro Halogenua:
H2 + X2 → 2HX
Trong điều kiện:
+ F2: Phản ứng được ngay cả ở trong bóng tối
+ CI2: Chỉ xảy ra phản ứng khi được chiếu sáng.
+ I2: Phải đun nóng, là phản ứng có tính thuận nghịch.
+ Br2: Chỉ xảy ra được phản ứng khi đun nóng ở nhiệt độ cao.
Tác dụng với nước
F2 tác dụng mãnh liệt với nước, thể hiện qua phương trình:
2H2O + 2F2 → 4HF + O2
CI2 và Br có phản ứng thuận nghịch với nước:
H2O + X2 ↔ HX + HXO (Axit Halogen hiđric và Axit Hipohalogenơ)
H2O + Cl2 ↔ HCl + HClO
I2 không phản ứng với nước.
Phản ứng với dung dịch kiềm
Dung dịch kiềm loãng nguội:
Cl2+ 2NaOH → NaCl + NaClO + H2O
X2 + 2NaOH → NaX + NaXO + H2O
Cl2 + Ca(OH)2 bột → CaOCl2 + H2O
2Cl2 + 2Ca(OH)2 dung dịch → CaCl2 + Ca(ClO)2 + 2H2O
Riêng F2:
2F2 + 2NaOH → 2NaF + H2O + OF2
Dung dịch kiềm đặc nóng:
3X2 + 6KOH → 5KX + KXO3 + 3H2O
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (100oC)
Tác dụng với dung dịch muối Halogenua
Tác dụng với dung dịch muối Halogenua của các nguyên tố Halogen có tính oxy yếu hơn, F2 không có phản ứng này:
X2 + 2NaX’ → 2NaX + X’2
(Trong đó: Tính oxy hóa của Halogen X’ yếu hơn Halogen X)
Các cặp oxy hóa khử của các nguyên tố Halogen được xếp theo chiều giảm dần tính khử của các ion X–
----------------------------------------
Trên đây VnDoc đã giới thiệu tới các bạn nội dung bài Nêu cấu hình electron nguyên tử halogen? Để có kết quả học tập tốt và hiệu quả hơn, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Hóa học 10, Chuyên đề Vật Lý 10, Chuyên đề Hóa học 10, Giải bài tập Toán 10. Tài liệu học tập lớp 10 mà VnDoc tổng hợp biên soạn và đăng tải.










