Cách viết công thức cấu tạo của các phân tử
Chuyên đề Hóa học lớp 10: Cách viết công thức cấu tạo của các phân tử được VnDoc sưu tầm và biên soạn giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo.
Bài tập: Sự hình thành liên kết cộng hóa trị
A. Phương pháp và ví dụ
1. Lý thuyết và phương pháp giải
a. Liên kết cộng hóa trị hình thành giữa các nguyên tử giống nhau
Sự hình thành đơn chất H2
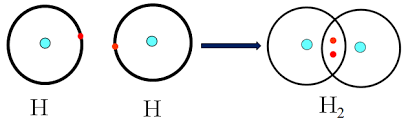
Mỗi chấm bên kí hiệu nguyên tố biểu diễn một electron ở lớp ngoài cùng.
Ký hiệu H:H là công thức electron; H-H là công thức cấu tạo.
Giữa 2 nguyên tử hidro có 1 cặp electron liên kết biểu thị bằng (-) đó là liên kết đơn.
Liên kết cộng hóa trị là gì?
Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tửu bằng một hay nhiều cặp electron chung.
Mỗi cặp electron chung tạo nên 1 liên kết cộng hóa trị, nên ta có liên kết đơn (trong phân tử H2), liên kết ba (trong phân tử N2)
- Viết cấu hình e của các nguyên tử tạo hợp chất
- Tính nhẩm số e mỗi nguyên tử góp chung = 8 – số e lớp ngoài cùng
- Biểu diễn các e lớp ngoài cùng và các cặp e chung (bằng các dấu chấm) lên xung quanh kí hiệu nguyên tử ⇒ công thức electron
- Thay mỗi cặp e chung bằng 1 gạch ngang ta được công thức cấu tạo
Lưu ý:
- Khi hai nguyên tử liên kết mà trong đó có một nguyên tử A đạt cấu hình bền còn nguyên tử B kia chưa thì lúc này A sử dụng cặp electron của nó để cho B dùng chung → hình thành liên kết cho nhận (hay phối trí) biểu diễn bằng → hướng vào nguyên tử nhận cặp electron đó.
- Khi có nhiều nguyên tử đều có thể đưa cặp electron ra cho nguyên tử khác dùng chung thì ưu tiên cho nguyên tử nào có độ âm điện nhỏ hơn.
- Khi viết công thức cấu tạo (CTCT) của:
* Axit có oxi: theo thứ tự
+ Viết có nhóm H – O
+ Cho O của nhóm H – O liên kết với phi kim trung tâm
+ Sau đó cho phi km trung tâm liên kết với O còn lại nếu có.
* Muối:
+ Viết CTCT của axit tương ứng trước.
+ Sau đó thay H ở axit bằng kim loại.
2. Ví dụ bài tập minh họa
Ví dụ 1. Trình bày sự hình thành liên kết cho nhận trong các phân tử và sau H3O+, HNO3
Đáp án hướng dẫn giải chi tiết
- Xét H3O+ ta có
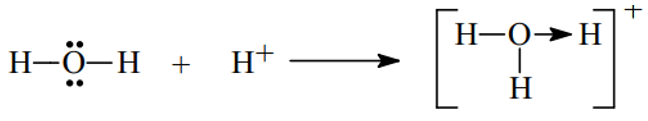
- Xét phân tử HNO3
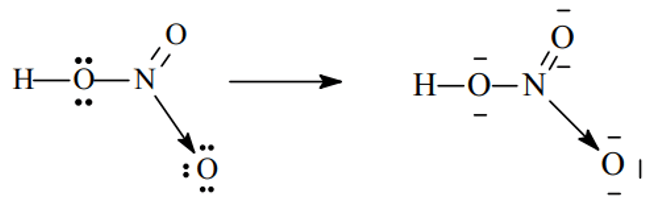
Sau khi hình thành các liên kết cộng hóa trị, N (chứ không phải O) sẽ cho 1 cặp electron đến nguyên tử O thứ ba (đang thiếu 2e để đạt cấu hình khí trơ) hình thành liên kết cho - nhận .
Chú ý:
- Cấu tạo phân tử và biểu diễn với liên kết cho nhận là để phù hợp với quy tắc bát tử.
- Với nguyên tử cho cặp electron có 3 lớp trở lên, có thể có hóa trị lớn hơn 4 nên còn biểu diễn bằng liên kết cộng hóa trị.
Ví dụ 2: Viết công thức cấu tạo của phân tử H2SO4 và HClO4 để thấy được quy tác bát tử chỉ đúng với 1 số trường hợp
Đáp án hướng dẫn giải chi tiết
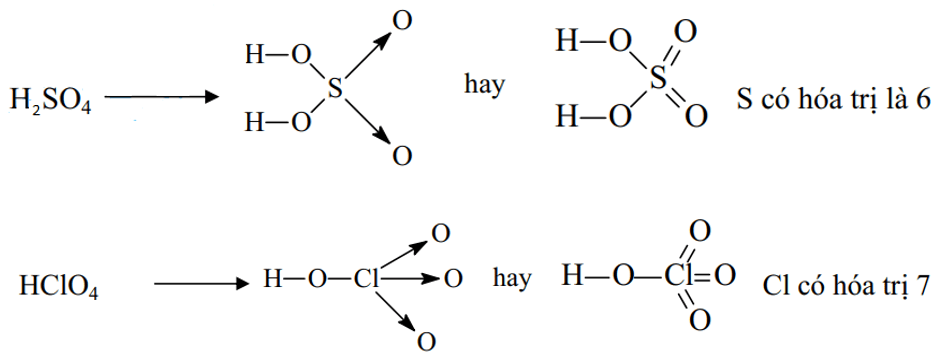
Ví dụ 3: Viết công thức electron và công thức cấu tạo các ion đa nguyên tử sau: CO32-, HCO3-
Đáp án hướng dẫn giải

Ví dụ 4. Viết công thức cấu tạo của các chất sau
Cl2O, Cl2O5, HClO3.
Đáp án hướng dẫn giải chi tiết
Cl2O:
![]()
Cl2O5:
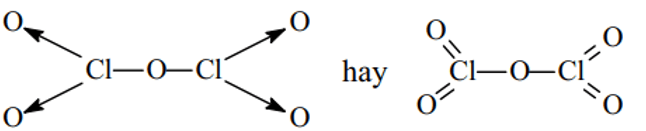
HClO3:
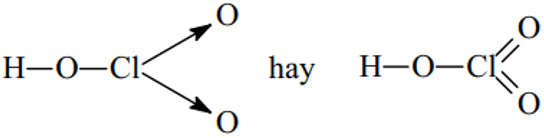
B. Bài tập vận dụng công thức cấu tạo của các phân tử
Câu 1. Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: PH3, SO2
Đáp án hướng dẫn giải
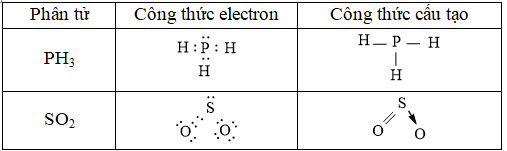
Câu 2. Viết công thức electron, công thức cấu tạo của HClO, HCN, HNO2.
Đáp án hướng dẫn giải chi tiết
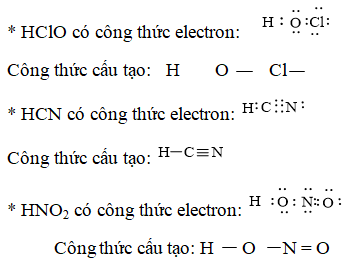
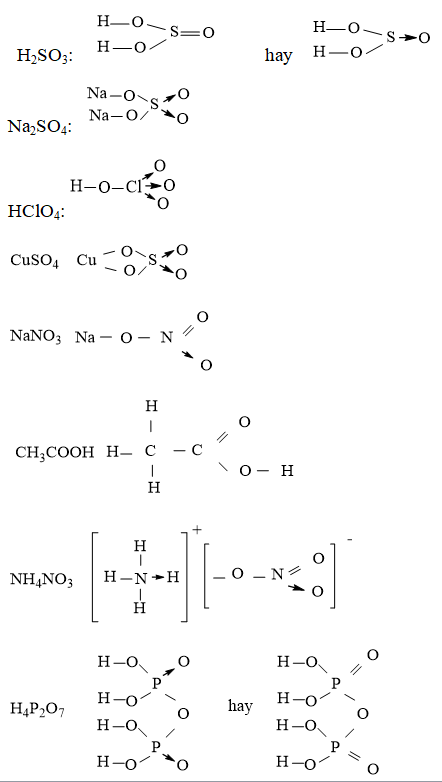
Câu 3. Viết công thức cấu tạo của các phân tử và ion sau: H2SO3, Na2SO4, HClO4, CuSO4, NaNO3, CH3COOH, NH4NO3, H4P2O7.
Đáp án hướng dẫn giải chi tiết
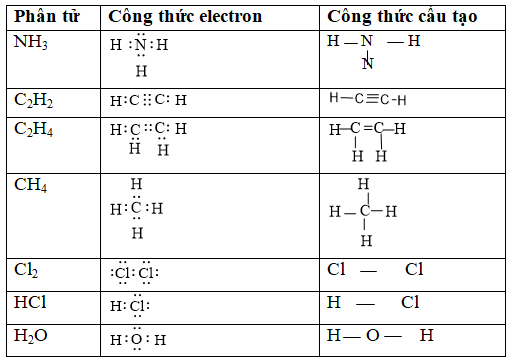
Câu 4. Viết công thức electron, công thức cấu tạo của các phân tử:NH3, C2H2, C2H4, CH4, Cl2, HCl, H2O.
Đáp án hướng dẫn giải chi tiết
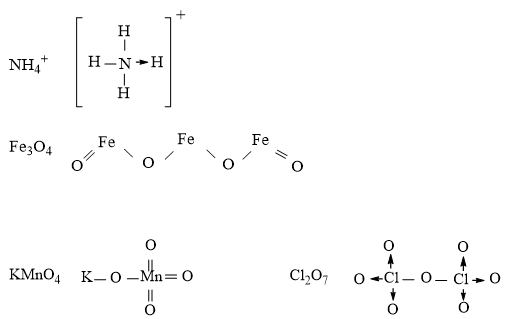
Câu 5. Viết công thức cấu tạo của các phân tử và ion sau: NH4+, Fe3O4, KMnO4, Cl2O7
Đáp án hướng dẫn giải chi tiết
Câu 6. Viết công thức electron và công thức cấu tạo các chất sau:HNO3, Al(OH)3, K2Cr2O7, N2O5, Al2S3, H2CrO4, PCl5
Đáp án hướng dẫn giải chi tiết
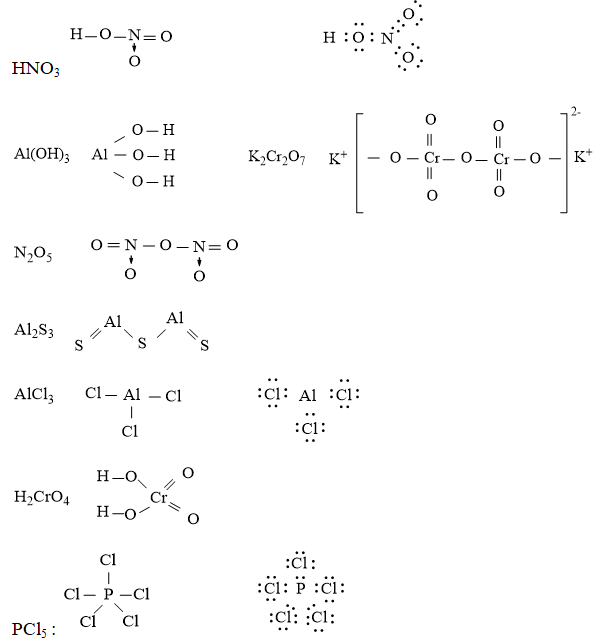
Đáp án hướng dẫn giải chi tiết
Cl2O: Cl - O - Cl
Axit tương ứng: H - O - Cl; HClO: Axit hipocloro
HClO2: H-O-Cl→O hay H-O-Cl =O: Axit cloro
Cl2O5:
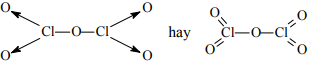
HClO3:
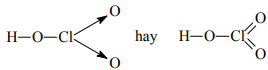
Cl2O7:
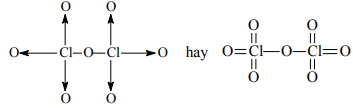
Câu 8. R là một nguyên tố phi kim. Tổng đại số số oxi hóa dương cao nhất với 2 lần số oxi hóa âm thấp nhất của R là +2. Tổng số proton và nơtron của R nhỏ hơn 34.
1. Xác định R2.
2. X là hợp chất khí của R với hiđro, Y là oxit của R có chứa 50% oxi về khối lượng. Xác định công thức phân tử của X và Y.
3. Viết công thức cấu tạo các phân tử RO2; RO3; H2RO4.
Đáp án hướng dẫn giải chi tiết
Gọi số oxi hóa dương cao nhất và số oxi hóa âm thấp nhất của R lần lượt là +m và -n.
Số oxi hóa cao nhất của R trong oxit là +m nên ở lớp ngoài cùng nguyên tử R có m electron.
Số oxi hóa trong hợp chất của R với hiđro là -n nên để đạt được cấu hình 8 electron bão hòa của khí hiếm, lớp ngoài cùng nguyên tử R cần nhận thêm n electron.
Ta có: m + n = 8. Mặt khác, theo bài ra: +m + 2(-n) = +2 => m - 2n = 2.
Từ đây tìm được: m = 6 và n = 2. Vậy R là phi kim thuộc nhóm VI.
Số khối của R < 34 nên R là O hay S. Do oxi không tạo được số oxi hóa cao nhất là +6 nên R là lưu huỳnh.
2. Trong hợp chất X, S có số oxi hóa thấp nhất nên X có công thức là H2S.
Gọi công thức oxit Y là SOn.
Do %S = 50% nên 32/16n = 50/50 => n = 2
Công thức của Y là SO2
3. Công thức cấu tạo của SO2; SO3; H2SO4
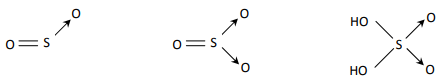
Câu 9. Để khử hoàn toàn 16 gam oxit của một kim loại thành kim loại cần dùng 6,72 lit H2. Hòa tan hết lượng kim loại thu được vào dung dịch HCl loãng thấy thoát ra 4,48 lit khí H2. Biết các khí đo ở điều kiện tiêu chuẩn. Xác định công thức của oxit. Cho biết số oxi hóa và hóa trị của kim loại trong oxit.
Đáp án hướng dẫn giải chi tiết
Gọi công thức oxit là RxOy = a mol.
RxOy + yH2 → xR + yH2O
(mol): a ay ax
Ta có: a(Mx + 16y) = 16 và ay = 0,3. Như vậy Max = 11,2.
2R + 2nHCl → 2RCln + nH2
(mol): ax 0,5nax
Ta có: 0,5nax = 0,2 hay nax = 0,4.
Lập tỉ lệ: M/n = Max/nax = 11,2/0,4 . Vậy M = 28n.
Ta lập bảng sau:
| n | 1 | 2 | 3 |
| M | 28 loại | 56 thỏa mãn | 84 loại |
Vậy kim loại M là Fe.
Lập tỉ lệ: x/y = ax/ay = 2/3. Vậy công thức oxit là Fe2O3.
Số oxi hóa của sắt trong oxit là +3, hóa trị của sắt là III.
C. Bài tập viết công thức cấu tạo của các phân tử
1. Câu hỏi bài tập tự luận
Câu 1. Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: PH3, SO2
Câu 2. Viết công thức electron, công thức cấu tạo của HClO, HCN, HNO2.
Câu 3. Viết công thức cấu tạo của các phân tử và ion sau: H2SO3, Na2SO4, HClO4, CuSO4, NaNO3, CH3COOH, NH4NO3, H4P2O7.
Câu 4. Viết công thức electron, công thức cấu tạo của các phân tử:NH3, C2H2, C2H4, CH4, Cl2, HCl, H2O.
Câu 5. Viết công thức cấu tạo của các phân tử và ion sau: NH4+, Fe3O4, KMnO4, Cl2O7
Câu 6. Viết công thức electron và công thức cấu tạo các chất sau: HNO3, Al(OH)3, K2Cr2O7, N2O5, Al2S3, H2CrO4, PCl5
Câu 7. Giải thích tại sao nito là một khí tương đối trơ ở nhiệt độ thường? Viết công thức electron, công thức cấu tạo của NH3, NH4Cl, HNO3
Câu 8. Hãy trình bày đặc điểm cấu tạo không gian của phân tử metan (CH4)
Câu 9. Năng lương liên kết là gì? Năng lượng liên kết có ảnh hưởng gì đến hiệu nhiệt của phản ứng.
Câu 10. Trong các loại mạng tinh thể (nguyên tử, phân tử, kim loại, ion), thì kimcuowng, photpho trắng, nước đá, KCl, Mg thuộc loại mạng tinh thể nào.
Câu hỏi trắc nghiệm liên quan
Câu 1. Nguyên tử Al có 3 electron hóa trị. Kiểu liên kết hóa học nào được hình thành khi nó liên kết với 3 nguyên tử flo:
A. Liên kết kim loại.
B. Liên kết cộng hóa trị có cực.
C. Liên kết cộng hóa trị không cực.
D. Liên kết ion.
Câu 2. Dãy nào sau đây không chứa hợp chất ion?
A. NH4Cl, OF2, H2S.
B. CO2, Cl2, CCl4
C. BF3, AlF3, CH4 .
D. I2, CaO, CaCl2.
Câu 3. Cho nguyên tử Liti (Z = 3) và nguyên tử Oxi (Z = 8). Nội dung nào sau đây không đúng:
A. Cấu hình e của ion Li+: 1s2 và cấu hình e của ion O2–: 1s22s22p6.
B. Những điện tích ở ion Li+và O2–do: Li → Li ++ e và O + 2e → O2– .
C. Nguyên tử khí hiếm Ne có cấu hình e giống Li +và O2–.
D. Có công thức Li2O do: mỗi nguyên tử Li nhường 1 e mà một nguyên tử O nhận 2 e.
Câu 4: Nước(H2O) có vai trò vô cùng quan trọng đối với đời sống sinh hoạt của con người. Nước là phân tử có liên kết cộng hóa trị,số liên kết cộng hoá trị có trong phân tử H2O là bao nhiêu?
A. 1
B. 2
C. 3
D. 4
Câu 5: Hidrosunfua(H2S) là chất khí có mùi trứng thối và rất độc, sinh ra trong quá trình phân hủy xác động thực vật. Hidrosunfua là phân tử có liên kết cộng hóa trị, số liên kết cộng hoá trị có trong phân tử H2S là bao nhiêu?
A. 1
B. 2
C. 3
D. 4
Câu 6. Trong phân tử CH4 có số đôi e chưa tham gia liên kết là bao nhiêu?
A. 0
B. 1
C. 2
D. 3
Câu 7: Trong phân tử CO2 có số đôi e chưa tham gia liên kết là bao nhiêu?
A. 4
B. 3
C. 2
D. 1
Cấu hình electron nguyên tử của C (Z = 6) là 1s 2 2s 2 2p 2 , nguyên tử cacbon có 4 electron ở lớp ngoài cùng.
Cấu hình electron nguyên tử của O (Z = 8) là 1s 2 2s 2 2p 4 , nguyên tử oxi có 6 electron ở lớp ngoài cùng.
Trong phân tử CO 2 , nguyên tử C nằm giữa hai nguyên tử O và góp chung với mỗi nguyên tử O hai electron, mối nguyên tử O góp chung với nguyên tử C hai electron tạo ra 2 liên kết đôi.
Ta có công thức cấu tạo: O=C=O.
→ Số cặp electron dùng chung trong phân tử CO 2 là 4
Câu 8: Trong phân tử NH3 có số đôi e chưa tham gia liên kết là bao nhiêu?
A. 0
B. 1
C. 2
D. 3
Câu 9: Trong phân tử N2 có số đôi e chưa tham gia liên kết là bao nhiêu?
A. 0
B. 1
C. 2
D. 3
Cấu hình e của 7N là 1s22s22p3
=> N thiếu 3 e để đạt được cấu hình bền của khí hiếm Ne 1s22s22p6
=> Trong phân tử N2, mỗi nguyên tử N góp chung 3e để mỗi nguyên tử đạt cấu hình bền
=> Số cặp e dùng chung là 3
Câu 10: Trong phân tử HF có số đôi e chưa tham gia liên kết là bao nhiêu?
A. 0
B. 1
C. 2
D. 3
.................................
Mời các bạn tham khảo thêm một số tài liệu liên quan:








